Яичниковая и надпочечниковая гиперандрогения – как женскому организму справиться с мужскими гормонами? Идиопатическая гиперандрогения. Лечение и симптомы гиперандрогении у женщин Наличие предрасположенности к гиперандрогении у женщин с метаболическим синд
– группа эндокринопатий, характеризующихся избыточной секрецией или высокой активностью мужских половых гормонов в женском организме. Проявлениями различных синдромов, схожих по симптоматике, но различных по патогенезу, выступают нарушения обменной, менструальной и репродуктивной функций, андрогенная дермопатия (себорея, акне, гирсутизм, алопеция). Диагноз гиперандрогении у женщин основан на данных осмотра, гормонального скрининга, УЗИ яичников, КТ надпочечников и гипофиза. Коррекцию гиперандрогении у женщин проводят с помощью КОК или кортикостероидов, опухоли удаляют оперативно.

Общие сведения
Гиперандрогения у женщин – понятие, объединяющее патогенетически разнородные синдромы, обусловленные повышенной продукцией андрогенов эндокринной системой или чрезмерной восприимчивостью к ним тканей–мишеней. Значимость гиперандрогении в структуре гинекологической патологии объясняется ее широким распространением среди женщин детородного возраста (4–7,5% у девочек-подростков, 10-20% у пациенток старше 25 лет).
Андрогены - мужские половые гормоны группы стероидов (тестостерон, АСД, ДГЭА-С, ДГТ) синтезируются в организме женщины яичниками и корой надпочечников, меньше - подкожной жировой клетчаткой под контролем гипофизарных гормонов (АКТГ и ЛГ). Андрогены выступают предшественниками глюкокортикоидов, женских половых гормонов – эстрогенов и формируют либидо. В пубертате андрогены являются наиболее значимыми в процессе ростового скачка, созревания трубчатых костей, замыкания диафизаро-эпифизарных хрящевых зон, появления оволосения по женскому типу. Однако избыток андрогенов в женском организме вызывает каскад патологических процессов, нарушающих общее и репродуктивное здоровье.
Гиперандрогения у женщин не только обусловливает возникновение косметических дефектов (себореи , акне , алопеции , гирсутизма , вирилизации), но и становится причиной расстройства метаболических процессов (обмена жиров и углеводов), менструальной и репродуктивной функции (аномалий фолликулогенеза, поликистозной дегенерации яичников, дефицита прогестерона, олигоменореи , ановуляции, невынашивания беременности, бесплодия у женщин). Продолжительная гиперандрогения в сочетании с дисметаболизмом повышает риск развития гиперплазии эндометрия и рака шейки матки , сахарного диабета II типа и сердечно-сосудистой патологии у женщин.

Причины гиперандрогении у женщин
Развитие транспортной формы гиперандрогении у женщин отмечается на фоне недостаточности глобулина, связывающего половые стероиды (ГСПС), блокирующего активность свободной фракции тестостерона (при синдроме Иценко-Кушинга , гипотиреозе, дислипопротеидемии). Компенсаторный гиперинсулизм при патологической инсулинорезистентности клеток-мишеней способствует усилению активации андрогенсекретирующих клеток овариально-адреналового комплекса.
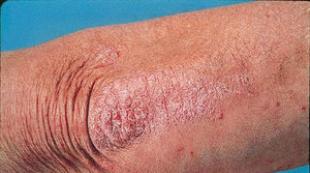
У 70–85% женщин с акне гиперандрогения наблюдается при нормальных показателях андрогенов в крови и повышенной чувствительности к ним сальных желез вследствие увеличения плотности гормональных рецепторов кожи. Основной регулятор пролиферации и липогенеза в сальных железах - дигидротестостерон (ДГТ) - стимулирует гиперсекрецию и изменение физико–химических свойств кожного сала, приводящих к закрытию выводных протоков сальных желез, образованию комедонов, появлению акне и угревой болезни.
Гирсутизм связан с гиперсекрецией андрогенов в 40-80% случаев, в остальных – с усиленным превращением тестостерона в более активный ДГТ, провоцирующий избыточный рост стержневых волос в андрогенчувствительных зонах женского тела или выпадение волос на голове. Кроме этого, у женщин может встречаться ятрогенная гиперандрогения, обусловленная приемом лекарственных препаратов с андрогенной активностью.
Симптомы гиперандрогении у женщин
Клиника гиперандрогении у женщин зависит от степени выраженности нарушений. При гиперандрогении неопухолевого генеза, например, при СПКЯ , клинические признаки медленно прогрессируют в течение нескольких лет. Начальные симптомы манифестируют в период пубертата, клинически проявляясь жирной себореей, вульгарными угрями, нарушением менструального цикла (нерегулярностью, чередованием задержек и олигоменореи, в тяжелых случаях - аменореей), избыточным оволосением лица, рук, ног. В последующем развивается кистозная трансформация структуры яичников, ановуляция, недостаточность прогестерона, относительная гиперэстрогенемия, гиперплазия эндометрия, снижение фертильности и бесплодие. В постменопаузе отмечается выпадение волос сначала в височных областях (битемпоральная алопеция), затем в теменной области (париетальная алопеция). Выраженная андрогенная дерматопатия у многих женщин приводит к развитию невротических и депрессивных состояний.
Гиперандрогения при АГС характеризуется вирилизацией гениталий (женским псевдогермафродитизмом), маскулинизацией , поздним менархе, недоразвитием груди, огрублением голоса, гирсутизмом, угрями . Тяжелая гиперандрогения при нарушении функции гипофиза сопровождается высокой степенью вирилизациии, массивным ожирением по андроидному типу. Высокая активность андрогенов способствует развитию метаболического синдрома (гиперлипопротеинемии, инсулинорезистентности, СД II типа), артериальной гипертензии , атеросклероза , ИБС . При андрогенсекретирующих опухолях надпочечников и яичников симптомы развиваются стремительно и быстро прогрессируют.
Диагностика гиперандрогении у женщин
В целях диагностики патологии проводится тщательный сбор анамнеза и физикальный осмотр с оценкой полового развития, характера менструальных нарушений и оволосения, признаков дермопатии; определяется общий и свободный тестостерон, ДГТ, ДЭА-С, ГСПС в сыворотке крови. Выявление избытка андрогенов требует уточнения его природы - надпочечниковой или яичниковой.
Маркером адреналовой гиперандрогении служит повышенный уровень ДГЭА-С, а яичниковой - увеличение количества тестостерона и АСД. При очень высоком уровне ДГЭА-С >800 мкг/дл или общего тестостерона >200 нг/дл у женщин возникает подозрение на андрогенсинтезирующую опухоль, что требует выполнения КТ или МРТ надпочечников, УЗИ органов малого таза, при сложности визуализации новообразования - селективной катетеризации надпочечниковых и яичниковых вен. УЗ-диагностика позволяет также установить наличие поликистозной деформации яичников.
При овариальной гиперандрогении оценивают показатели гормонального фона женщины: уровни пролактина, ЛГ, ФСГ, эстрадиола в крови; при адреналовой - 17-ОПГ в крови, 17-КС и кортизола в моче. Возможно проведение функциональных проб с АКТГ, проб с дексаметазоном и ХГЧ, выполнение КТ гипофиза. Обязательным является исследование углеводного и жирового обмена (уровней глюкозы, инсулина, HbA1C, общего холестерина и его фракций, глюкозо-толерантного теста). Женщинам с гиперандрогенией показаны консультации эндокринолога, дерматолога, генетика.
Лечение гиперандрогении у женщин
Лечение гиперандрогении длительное, требующее дифференцированного подхода к тактике ведения пациенток. Основным средством коррекции гиперандрогенных состояний у женщин выступают эстроген-гестагенные оральные контрацептивы с антиандрогенным эффектом. Они обеспечивают торможение продукции гонадотропинов и процесса овуляции, подавление секреции овариальных гормонов, в т. ч., тестостерона, подъем уровня ГСПС, блокировку андрогеновых рецепторов. Гиперандрогению при АГС купируют кортикостероидами, их применяют также для подготовки женщины к беременности и в период гестации при данном типе патологии. В случае высокой гиперандрогении курсы антиандрогенных препаратов у женщин продлевают до года и более.
При андрогензависимой дерматопатии клинически эффективна периферическая блокада андрогенных рецепторов. Одновременно проводится патогенетическое лечение субклинического гипотиреоза, гиперпролактинемии и др. нарушений. Для лечения женщин с гиперинсулизмом и ожирением применяются инсулиновые сенситайзеры (метформин), меры по снижению веса (гипокалорийная диета, физические нагрузки). На фоне проводимого лечения осуществляется контроль динамики лабораторных и клинических показателей.
Андрогенсекретирующие опухоли яичников и надпочечников имеют обычно доброкачественную природу, но при их выявлении обязательно хирургическое удаление. Рецидивы маловероятны. При гиперандрогении показано диспансерное наблюдение и медицинское сопровождение женщины для успешного планирования беременности в будущем.
Гиперандрогения у женщин - состояние, при котором в крови определяется повышенный уровень андрогенов, а также фиксируются клинические данные избытка мужских половых гормонов.
Встречается у разных возрастных групп. Основными причинами гиперандрогении являются адреногенитальный синдром (АГС) и поликистоз яичников (СПКЯ). Лечение гиперандрогении направлено на коррекцию гормонального фона и профилактику последствий избытка андрогенов. В норме гормональный статус женщины допускает определенный уровень андрогенов в крови. Из них под действием ароматазы образуется часть эстрогенов.
Избыточное же количество приводит к нарушению репродуктивной функции, повышается риск онкологических заболеваний. В МКБ-10 нет классификации данного синдрома, так как он не является болезнью.
Что это такое?
Гиперандрогения у женщин – понятие, объединяющее патогенетически разнородные синдромы, обусловленные повышенной продукцией андрогенов эндокринной системой или чрезмерной восприимчивостью к ним тканей–мишеней. Значимость гиперандрогении в структуре гинекологической патологии объясняется ее широким распространением среди женщин детородного возраста (4–7,5% у девочек-подростков, 10-20% у пациенток старше 25 лет).
Причины возникновения
Гиперандрогения – проявление широкого спектра синдромов. Специалисты называют три наиболее вероятные причины гиперандрогении:
- повышение уровня андрогенов в сыворотке крови;
- превращение андрогенов в метаболически активные формы;
- активная утилизация андрогенов в тканях-мишенях вследствие аномальной чувствительности андрогенных рецепторов.
Чрезмерный синтез мужских половых гормонов, как правило, связан с нарушением функции яичников. Чаще всего встречается синдром поликистозных яичников (СПКЯ) – образование множественных мелких кист на фоне комплекса эндокринных расстройств, включая патологии щитовидной и поджелудочной железы, гипофиза, гипоталамуса и надпочечников. Заболеваемость СПКЯ среди женщин фертильного возраста достигает 5–10%.
Гиперсекреция андрогенов также наблюдается при следующих эндокринопатиях:
- адреногенитальный синдром;
- врожденная гиперплазия надпочечников;
- синдром галактореи-аменореи;
- стромальный текоматоз и гипертекоз;
- вирилизирующие опухоли яичников и надпочечников, продуцирующие мужские гормоны.
Гиперандрогения на почве трансформации половых стероидов в метаболически активные формы часто вызывается разнообразными нарушениями липидно-углеводного обмена, сопровождающихся инсулинорезистентностью и ожирением. Чаще всего наблюдается трансформация продуцируемого яичниками тестостерона в дигидротестостерон (ДГТ) – стероидный гормон, стимулирующий выработку кожного сала и рост стержневых волос на теле, а в редких случаях – потерю волос на голове.
Компенсаторная гиперпродукция инсулина стимулирует выработку клеток яичников, продуцирующих андрогены. Транспортная гиперандрогения наблюдается при нехватке глобулина, связывающего свободную фракцию тестостерона, что характерно для синдрома Иценко – Кушинга, дислипопротеидемии и гипотиреоза. При высокой плотности андрогенных рецепторов клеток тканей яичников, кожи, волосяных фолликулов, сальных и потовых желез симптомы гиперандрогении могут наблюдаться при нормальном уровне половых стероидов в крови.
Степень выраженности симптомов зависит от причины и формы эндокринопатии, сопутствующих заболеваний и индивидуальных особенностей.
Вероятность манифестации патологических состояний, ассоциированных с симптомокомплексом гиперандрогении, зависит от ряда факторов:
- наследственная и конституциональная предрасположенность;
- хронические воспалительные заболевания яичников и придатков;
- выкидыши и аборты, особенно в ранней молодости;
- нарушения обмена веществ;
- избыточная масса тела;
- вредные привычки – курение, злоупотребление алкоголем и наркотиками;
- дистресс;
- длительный прием лекарств, содержащих стероидные гормоны.
Идиопатическая гиперандрогения является врожденной или возникает в детстве либо в пубертатном периоде без видимых причин.
Классификация
В зависимости от причины, уровня и механизма развития патологии выделяют следующие виды гиперандрогении.
- Яичниковая. Характеризуется нарушениями генетического или приобретенного происхождения. Для овариальной гиперандрогении свойственно стремительное развитие и внезапное появление симптомов. В яичниках происходит превращение андрогенов в эстрогены под действием фермента ароматазы. При нарушении его работы возникает дефицит женских половых гормонов и избыток мужских. Помимо этого, гиперандрогению яичникового генеза могут провоцировать гормонально-активные опухоли данной локализации.
- Надпочечниковая. Такую гиперандрогению вызывают опухоли надпочечников (чаще всего андростеромы) и адреногенитальный синдром. Последняя патология обусловлена генетическими аномалиями гена, который отвечает за образование фермента С21-гидроксилаза. Недостаток этого вещества на протяжении длительного времени может восполняться работой других гормонопродуцирующих органов, поэтому состояние имеет скрытое течение. При психоэмоциональном перенапряжении, беременности и других стрессовых факторах дефицит фермента не покрывается, поэтому клиника АГС становится более явной. Надпочечниковая гиперандрогения характеризуется дисфункцией яичников и нарушением менструального цикла, отсутствием овуляции, аменореей, недостаточностью желтого тела при созревании яйцеклетки.
- Смешанная . Тяжелая форма гиперандрогении, сочетает в себе дисфункцию яичников и надпочечников. Пусковым механизмом развития смешанной гиперандрогении являются нейроэндокринные расстройства, патологические процессы в области гипоталамуса. Проявляется нарушениями жирового обмена, часто бесплодием или невынашиванием.
- Центральная и периферическая . Связана с дисфункцией гипофиза и гипоталамуса, нарушением работы нервной системы. Возникает дефицит фолликулостимулирующего гормона, что нарушает созревание фолликулов. Как итог - повышается уровень андрогенов.
- Транспортная. Эта форма гиперандрогении основана на дефиците глобулина, отвечающего за связывание половых стероидов в крови, а также блокирующего чрезмерную активность тестостерона.
По очагу зарождения патологии выделяют следующие виды гиперандрогении:
- первичная - берет начало в яичниках и надпочечниках;
- вторичная - очаг зарождения в гипофизе.
По способу развития патологии выделяются:
- наследственная;
- приобретенная.
По степени концентрации мужских гормонов гиперандрогения бывает:
- относительная - уровень андрогенов в норме, но сенситивность к ним органов-мишеней увеличена, и мужские половые гормоны имеют склонность к превращению в активные формы;
- абсолютная - допустимая норма содержания андрогенов превышена.

Симптомы
Симптомы гиперандрогении у женщин могут варьировать от незначительных (избыточный рост волос на теле) до тяжелых (развитие вторичных мужских половых признаков).
Главными проявлениями патологических нарушений являются:
- акне – возникает при повышенной жирности кожи, которая приводит к закупорке и воспалениям сальных желез;
- себорея волосистой кожи головы;
- гирсутизм – появление сильного оволосения в местах нетипичных для женщин (лице, груди, животе, ягодицах);
- истончение и выпадение волос на голове, появление залысин;
- усиленный рост мышц, формирование мускулатуры по мужскому типу;
- огрубление тембра голоса;
- нарушение менструального цикла, скудость выделений, иногда полное прекращение менструаций;
- повышенное половое влечение.
Происходящие сбои в гормональном балансе становятся причиной развития сахарного диабета, появления лишнего веса, нарушений липидного обмена. Женщины становятся очень восприимчивы к различным инфекционным заболеваниям. У них нередко развиваются депрессии, хроническая усталость, повышенная раздражительность и общая слабость.
Одним из наиболее тяжелых последствий гиперандрогении является вирилизация или вирильный синдром. Так называют патологию развития женского организма, при которой он приобретает ярко выраженные мужские признаки. Вирилизация относится к редким отклонениям, ее диагностируют только у одной пациентки из 100, у которых отмечают чрезмерный рост волос на теле.
У женщины формируется мужская фигура с усиленным ростом мышц, полностью прекращаются месячные, значительно увеличивается размеры клитора. Очень часто подобные признаки развиваются у женщин, которые бесконтрольно принимают стероиды для повышения выносливости и физической силы при занятиях спортом.
Гиперандрогения при беременности
Среди всех возможных причин развития самопроизвольного аборта у беременной женщины в первом триместре, гиперандрогения занимает лидирующую позицию. К сожалению, во время обнаружения признаков гиперандрогении у женщины в период уже имеющейся беременности крайне затруднительно определить, врожденный или приобретенный характер имеет данная патология. В этом периоде определение генеза заболевания не имеет столь большого значения, так как первоочередно необходимо осуществлять все мероприятия по сохранению беременности.
Фенотипические признаки гиперандрогении у беременной женщины ничем не отличаются от проявлений данного патологического состояния у любой другой представительницы женского пола, с той лишь разницей, что в некоторых ситуациях гиперандрогения проявляется в виде прерывания беременности на раннем сроке, что не всегда расценивается женщиной как выкидыш. Развитие самопроизвольного выкидыша на раннем сроке обусловлено недостаточным прикреплением плодного яйца к стенке матки и отторжением его даже при малейшем травматическом влиянии. Ярким клиническим проявлением данного состояния является обнаружение влагалищного кровотечения, которое кстати, может быть не столь интенсивным, тянущей боли в надлобковой области и нивелирование признаков раннего токсикоза.
После 14 недели беременности создаются физиологические условия для предотвращения факта прерывания беременности, так как в этом периоде отмечается повышение активности женских половых гормонов, секретируемых плацентой в большом количестве.
Еще одним критическим периодом возникновения угрозы прерывания беременности у женщины, страдающей гиперандрогенией, является 20 неделя беременности, когда происходит активный выброс дегидроэпиандростерона надпочечниками плода, что неизбежно провоцирует усиление андрогенизации беременной женщины. Осложнением данных патологических изменений является развитие признаков истмико-цервикальной недостаточности, которая может провоцировать наступление преждевременного родоразрешения. В третьем триместре беременности гиперандрогения является провокатором раннего излития околоплодных вод, вследствие чего женщина может родить раньше положенного срока.
Для определения гиперандрогении у беременной женщины целесообразно применять лишь лабораторные методы диагностики, принципиально отличающиеся от обследования остальной категории пациенток. С целью определения концентрации мужских половых гормонов необходимо исследовать мочу беременной женщины с определением «суммы 17- кетостероидов».
Следует учитывать, что не все случаи выявления признаков гиперандрогении у беременной женщины должны подвергаться медикаментозной коррекции, даже при условии подтверждения диагноза лабораторными методиками. Медикаментозные методы терапии применяются только в случае имеющейся угрозы вынашиванию плода. Препаратом выбора для лечения гиперандрогении при беременности является Дексаметазон, начальная суточная доза которого составляет ¼ таблетки, действие которого направлено на ингибирование функции гипофиза, оказывающего опосредованное влияние на продукцию мужских половых гормонов. Применение данного препарата оправдано полным отсутствием негативного влияния на развитие плода с одновременным положительным эффектом в отношении нивелирования признаков гиперандрогении.
В послеродовом периоде, женщины, страдающие гиперандрогенией, обязательно должны находиться под наблюдением не только гинеколога, но и эндокринолога, так как данное патологическое состояние склонно прогрессировать и провоцировать серьезные осложнения.
Осложнения
Спектр возможно осложнений при всех описанных выше заболеваниях крайне велик. Можно отметить только некоторые, самые важные:
- При врожденной патологии возможны аномалии развития, самые распространенные из них — аномалии развития половых органов.
- Метастазирования злокачественных опухолей – осложнение, более характерное для опухолей надпочечников.
- Осложнения со стороны других систем органов, которые подвергаются негативному влиянию изменения гормонального фона при патологии надпочечников, гипофиза и яичников: хроническая почечная недостаточность, патология щитовидной железы и т.д.
Этим простым перечислением список далеко не окончен, что говорит в пользу своевременного обращения к врачу, дабы предвосхитить их наступление. Только своевременная диагностика и квалифицированное лечение способствуют достижению положительных результатов.
Диагностика
В диагностике гиперандрогении имеют значение как жалобы, анамнез и данные объективного статуса пациента, так и лабораторные и инструментальные методы исследования. То есть после оценивания симптомов и данных анамнеза необходимо не только выявить факт повышения уровня тестостерона и других мужских половых гормонов в крови, но и обнаружить их источник – новообразование, синдром поликистозных яичников или иную патологию.
Половые гормоны исследуют на 5-7 день менструального цикла. Определяют уровень в крови общего тестостерона, ГСПГ, ДГЭА, фолликулостимулирующего, лютеинизирующего гормонов, а также 17-гидроксипрогестерона.
Чтобы обнаружить источник проблемы, проводят УЗИ органов малого таза (при подозрении на патологию яичников – с использованием трансвагинального датчика) либо, если есть возможность, магнитно-резонансную томографию данной области.
С целью диагностики опухоли надпочечников больному назначают компьютерную, магнитно-резонансную томографию или сцинтиграфию с радиоактивным йодом. Стоит отметить, что опухоли малого размера (менее 1 см в диаметре) во многих случаях диагностировать не удается.
Если результаты вышеперечисленных исследований отрицательные, пациенту может быть назначена катетеризация вен, уносящих кровь от надпочечников и яичников, с целью определения уровня андрогенов в крови, оттекающей непосредственно от этих органов.
Лечение гиперандрогении у женщин
Основной метод лечения гиперандрогении у женщин – прием эстроген-гестагенных оральных контрацептивов с антиандрогенным эффектом, например, Диане 35. Препараты замедляют синтез гонадотропинов, подавляют секрецию овариальных гормонов и нормализуют менструальный цикл. Иногда обходятся и гестагенными средствами, такими как Утрожестан.
Другие принципы лечения:
- Если женщине противопоказаны оральные контрацептивы, то их заменяют Спиронолактоном или Верошпироном. Они используются при тяжелом предменструальном синдроме и поликистозе яичников для блокады внутриклеточного рецептора дигидротестостерона и подавления синтеза тестостерона.
- Андрогенизация у женщин при адреногенитальном синдроме лечится при помощи глюкокортикоидов, таких как Дексаметазон и Преднизолон.
- В случае гипотиреоза или высокого уровня пролактина корректируют непосредственно концентрацию этих веществ. Количество андрогенов в таком случае нормализуется само.
- При гиперинсулизме и ожирении принимают сахароснижающий препарат Метформин, соблюдают диету и занимаются спортом.
- Доброкачественные новообразования яичников или надпочечников – показание к хирургическому вмешательству.
- Чтобы нормализовать менструальный цикл, часто используют Дюфастон. Его принимают даже после наступления беременности, чтобы снизить риск выкидыша.
- Устранить артериальную гипертензию помогают блокаторы ренин-ангиотензина (Вальсартан) и ингибиторы АПФ (Рамиприл, Периндоприл).
На схему терапии влияет и форма гиперандрогении. Пациенту может требоваться помощь по борьбе с гирсутизмом, нарушением репродуктивной функции или полным бесплодием. Целью лечения у беременных женщин, если есть угроза выкидыша, является сохранение беременности.

Профилактика
Гиперандрогения не имеет специфических мер профилактики.
К основным можно отнести соблюдение режима правильного питания и образа жизни. Каждой женщине необходимо помнить, что чрезмерное похудание способствует гормональным нарушениям и может приводить как к описанному состоянию, так и ко многим другим. Кроме того, не следует увлекаться занятиями спортом, что тоже (особенно при приеме стероидных препаратов) может приводить к гиперандрогении.
Реабилитацию требуют пациенты с гиперандрогенией опухолевого генеза, подвергшиеся оперативному и химиотерапевтическому лечению. Кроме того, обязательно консультация с психологом, особенно для молодых девушек с выраженным гирсутизмом и гинекологическими проблемами.
Для цитирования:
Пищулин А.А., Карпова Е.А. Овариальная гиперандрогения и метаболический синдром // РМЖ. 2001. №2. С. 93
Эндокринологический научный центр РАМН, Москва
С индром овариальной гиперандрогении неопухолевого генеза или гиперандрогенная дисфункция яичников, называемый ранее синдромом Штейна - Левенталя, в настоящее время, согласно классификации ВОЗ, больше известен в мировой литературе, как синдром поликистозных яичников (СПЯ).
Клиническая картина СПЯ проявляется хроническим ановуляторным состоянием яичников или выраженной гипофункцией желтого тела, что приводит к двустороннему увеличению размеров яичников с утолщением и склерозом белочной оболочки. Эти изменения проявляются нарушением менструальной функции - опсоменореей, аменореей, однако не исключается и развитие метроррагии. Нарушения фолликулогенеза приводят к развитию ановуляторного первичного или вторичного бесплодия.
Одним из основных диагностических критериев СПЯ является гиперандрогенемия - повышение уровня андрогенных стероидов в крови (таких как тестостерон, андростендион), что приводит к развитию гирсутизма и других андрогензависимых дермопатий.
Ожирение или избыточная масса тела часто сопутствуют СПЯ. Определение индекса массы тела (ИМТ) позволяет выявить степень ожирения. Измерение показателей объема талии (ОТ) и бедер (ОБ) и их соотношение указывает на тип ожирения (прогностически неблагоприятным является абдоминальный тип ожирения, при котором ОТ/ОБ > 0,85).
Кроме основных симптомов заболевания, клиническая картина во многом определяется общими обменными нарушениями, такими как дислипидемия, нарушение углеводного обмена, повышенным риском развития гиперпластических и опухолевых процессов со стороны гениталий. Дислипидемия заключается в повышении уровня триглицеридов, холестерина, липопротеидов низкой плотности, липопротеидов очень низкой плотности и снижении липопротеидов высокой плотности. Эти нарушения ведут к риску раннего развития атеросклеротических изменений сосудов, гипертонической болезни и ишемической болезни сердца.
Нарушения углеводного обмена заключаются в развитии комплекса инсулинорезистентность-гиперинсулинемия, что в последнее время является основным направлением в изучении патогенетических звеньев развития СПЯ.
В 60-х годах патогенез СПЯ связывали с первичным ферментативным дефектом овариальной 19-гидроксилазы и/или 3b-дегидрогеназы, объединяя эти нарушения в понятие первичного поликистоза яичников. Однако в работах последующих лет было показано, что ароматазная активность клеток гранулезы является ФСГ зависимой функцией.
Выявленный при СПЯ повышенный уровень лютенизирующего гормона (ЛГ), отсутствие его овуляторного пика, нормальный или сниженный уровень фолликулостимулирующего гормона (ФСГ) при нарушенном соотношении ЛГ/ФСГ (2,5-3) предполагал первичное нарушение гонадотропной регуляции стероидогенеза в овариальной ткани с развитием вторичного поликистоза яичников.
До середины 80-х годов считалось (теория S.S.C. Yen) , что пусковым механизмом в патогенезе СПЯ является избыточный синтез андрогенов надпочечниками в период адренархе в результате измененной чувствительности надпочечников к АКТГ или чрезмерной стимуляции сетчатой зоны коры надпочечников не АКТГ-подобным фактором или под влиянием b-эндорфинов , нейротрансмиттеров, например, дофамина . При достижении критической массы тела (особенно при превышении ее нормы) увеличивается периферическая конверсия андрогенов в эстрогены, прежде всего в печени и жировой ткани . Повышение уровня эстрогенов, в первую очередь эстрона, приводит к гиперсенсибилизации гонадотрофов по отношению к люлиберину (ГнРГ). Одновременно под действием эстрона увеличивается продукция гипоталамусом ГнРГ, повышается амплитуда и частота импульсов его секреции, в результате чего увеличивается продукция аденогипофизом ЛГ, нарушается соотношение ЛГ/ФСГ, возникает относительная недостаточность ФСГ . Усиление влияния ЛГ на яичники способствует повышению продукции андрогенов текальными клетками и их гиперплазии. Относительно низкий уровень ФСГ приводит к снижению активности ФСГ-зависимой ароматазы, и клетки гранулезы теряют способность ароматазировать андрогены в эстрогены. Гиперандрогения препятствует нормальному росту фолликулов и способствует формированию их кистозной атрезии. Отсутствие роста и созревания фолликулов еще более ингибирует секрецию ФСГ. Возросший пул андрогенов в периферических тканях конвертируется в эстрон. Замыкается порочный круг.
Таким образом результатом нарушения центральных и периферических механизмов регуляции стероидогенеза является развитие у больных с СПЯ функциональной овариальной гиперандрогении.
Патогенез СПЯ по S.S.C. Yen представлен на схеме 1:
Схема 1.
В начале 80-х годов ряд авторов предложили новую теорию патогенеза синдрома поликистозных яичников, отличную от теории S.S.C. Yen . Было обнаружено, что СПЯ связан с гиперинсулинемией, и этому синдрому свойственны как нарушение репродуктивной функции, так и метаболических процессов.
На наличие взаимосвязи между гиперинсулинемией и гиперандрогенией указывали еще в 1921 году Achard and Thieris . Они описали гиперандрогению у женщины, страдавшей ожирением и сахарным диабетом 2-го типа и назвали это состояние “диабет бородатых женщин”.
В дальнейшем Д. Барген обнаружил, что у женщин с СПЯ и гиперандрогенией отмечалась базальная и глюкозостимулированная гиперинсулинемия по сравнению с контрольной группой женщин одинакового веса, что предполагало наличие инсулинорезистентности. Выявилась прямая зависимость между уровнями инсулина и андрогенов, и было высказано предположение, что причиной гиперандрогении может быть гиперинсулинемия.
В 1988 году G. Reaven впервые высказал предположение о том, что ИР и компенсаторная гиперинсулинемия (ГИ) играют основную роль в развитии синдрома метаболических нарушений. Он назвал его “синдромом Х” . В настоящее время наиболее часто употребляют термин “метаболический синдром” или “синдром инсулинорезистентности” .
Гипотезы патогенеза гиперинсулинемии и гиперандрогении
Механизм возникновения гиперандрогении и гиперинсулинемии окончательно не изучен. Теоретически возможны три варианта взаимодействия: гиперандрогения (ГА) вызывает ГИ; ГИ приводит к ГА: имеется какой-то третий фактор, ответственный за оба феномена .
1. Предположение о том, что ГА вызывает ГИ основано на следующих фактах. У женщин, которые принимают оральные контрацептивы, содержащие прогестины с “андрогенными свойствами”, выявляется нарушение толерантности к глюкозе. Длительное назначение тестостерона транссексуалам сопровождается возникновением ИР . Показано, что андрогены влияют на состав мышечной ткани, увеличивая количество мышечных волокон второго типа, менее чувствительных к инсулину по сравнению с волокнами первого типа .
2. Большинство факторов свидетельствуют в пользу того, что ГИ приводит к ГА. Было показано, что ИР сохраняется у пациенток, подвергшихся субтотальному или тотальному удалению яичников, а также у женщин, длительно применявших агонисты-ГнРГ, когда отмечалась выраженная супрессия уровня андрогенов . Назначение диазоксида - препарата, подавляющего выделение инсулина поджелудочной железой, вызвало снижение уровня тестостерона (Т) и повышение уровня сексстероидсвязывающего глобулина (СССГ) у пациенток с СПЯ, ожирением и гиперинсулинемией. Внутривенное введение инсулина женщинам с СПЯ приводило к повышению уровня циркулирующих андростендиона и Т. Мероприятия, направленные на повышение чувствительности к инсулину (снижение веса, голодание и низкокалорийная диета), сопровождались понижением уровня андрогенов . Есть данные, что инсулин напрямую может подавлять продукцию СССГ печенью, а в условиях гиперинсулинемии этот эффект усиливается. При этом полагают, что инсулин, а не половые гормоны, является основным регулятором синтеза СССГ. Понижение уровня СССГ приводит к возрастанию концентрации свободного и, следовательно, биологически активного Т (в норме 98% Т находится в связанном состоянии) .
Гипотеза, связывающая ГА с гиперинсулинемией, не дает ответа на вопрос, каким образом яичник сохраняет чувствительность к инсулину при инсулинорезистентном состоянии организма. Было предложено несколько возможных объяснений. Так как инсулин обладает множеством функций, можно предположить селективный дефект некоторых из них. Может наблюдаться органоспецифичность чувствительности к инсулину. Но более вероятно предположение о том, что инсулин действует на яичник не только через рецепторы инсулина, но также через рецепторы инсулиноподобных факторов роста (ИФР) .
Инсулиновые рецепторы и рецепторы ИФР-1 были идентифицированы в яичниках человека (в стромальной ткани яичников здоровых женщин, женщин с СПЯ, в фолликулярной ткани и клетках гранулезы) . Инсулин может связываться с рецепторами ИФР-1, хотя с меньшим сродством, чем с собственными рецепторами. Однако при ГИ, а также в ситуации, когда рецепторы инсулина блокированы или имеется их дефицит, можно ожидать, что инсулин будет связываться с рецепторами ИФР-1 в большей степени .
Возможно, механизмы стимуляции инсулином/ИФР-1 стероидогенеза в яичнике могут быть разделены на неспецифические и специфические. Неспецифические заключаются в классическом действии инсулина на метаболизм глюкозы, аминокислот и синтез ДНК. В результате повышается жизнеспособность клетки и, следовательно, усиливается синтез гормонов . Специфические механизмы включают прямое действие инсулина/ИФР-1 на стероидогенные ферменты, синергизм между инсулином и ЛГ/ФСГ и влияние на количество рецепторов к ЛГ .
Инсулин/ИФР-1, действуя синергично с ФСГ, стимулируют ароматазную активность в культуре клеток гранулезы и тем самым увеличивают синтез эстрадиола. Кроме того, они приводят к повышению концентрации рецепторов ЛГ, усиливая ЛГ-зависимый синтез андростендиона тека- и стромальными клетками.
Возрастающая концентрация андрогенов в яичнике под действием инсулина/ИФР-1 вызывает атрезию фолликулов, что приводит к постепенной элиминации эстроген- и прогестеронпродуцирующих клеток гранулезы, с последующей гиперплазией текальных клеток и лютеинизацией межуточной ткани яичника, которые являются местом продукции андрогенов. Этим объясняется тот факт, что стимуляция яичникового стероидогенеза инсулином проявляется преимущественно в виде гиперандрогении.
Было высказано предположение, что инсулин/ИФР-1 могут стимулировать как ЛГ-зависимую активность цитохрома Р450с17a в яичниках, так и АКТГ-зависимую активность Р450с17a в надпочечниках. Этим, по-видимому, объясняется частое сочетание яичниковой и надпочечниковой форм гиперандрогении у пациенток с СПЯ.
Возможна также взаимосвязь с теорией S.S.C. Yen об участии надпочечникового стероидогенеза в патогенезе СПЯ (схема 2).

Схема 2. Действие инсулина при синдроме поликистозных яичников
V. Insler (1993), проведя исследование уровней инсулина, ИФР-1, гормона роста и их корреляции с уровнями гонадотропинов и андрогенов у женщин с СПЯ, предложил две модели развития данного синдрома. У пациенток с ожирением ГИ вызывает избыточную продукцию андрогенов через рецепторы ИФР-1, которые, действуя в синергизме с ЛГ, вызывают повышение активности цитохрома Р450с17a, основного контролирующего фермента в синтезе андрогенов. У пациенток с нормальной массой тела относительное повышение концентрации гормона роста стимулирует избыточную продукцию ИФР-1. С этого момента синергизм с ЛГ приводит к гиперпродукции андрогенов по тому механизму, что и у пациенток с ожирением. Повышение уровня андрогенов вызывает изменение функции гипоталамических центров, приводя к нарушению секреции гонадотропинов и типичным для СПЯ изменениям (схема 3).
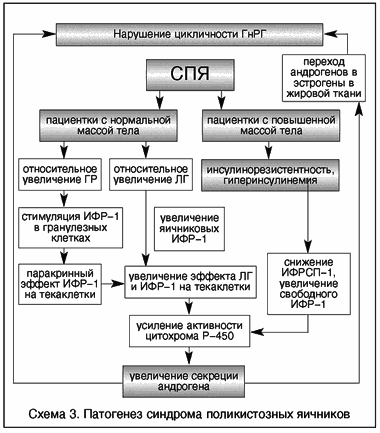
Схема 3. Патогенез синдрома поликистозных яичников
3. Однако имеется ряд хорошо известных состояний ИР, которые не связаны с ГА, например, простое ожирение и СД 2 типа . Для объяснения, почему не у всех пациенток с ожирением и ГИ развивается гиперандрогения и СПЯ, выдвинута гипотеза о существовании генетической предрасположенности к стимулирующему действию инсулина на синтез андрогенов в яичнике . Очевидно, существует ген или группа генов, которые делают яичники женщины с СПЯ более чувствительными к стимуляции инсулином продукции андрогенов .Молекулярные механизмы, приводящие к развитию инсулинорезистентности, до конца не изучены. Однако последние достижения в области молекулярной биологии позволили определить структуру гена, кодирующего рецептор к инсулину у женщин с овариальной гиперандрогенией.
Moller и Flier изучали последовательность аминокислот в структуре ДНК-цепей у больных с овариальной гиперандрогенией. Они обнаружили замещение триптофана на серозин в кодоне 1200. Исследователи предположили, что такое изменение нарушает процесс активации тирозин-киназной системы в рецепторе к инсулину. Низкая активность инсулиновых рецепторов приводит к развитию ИР и компенсаторной ГИ.
Yoshimasa et al. описали другой вариант точечной мутации у больной с гиперандрогенией, инсулинорезистентностью и черным акантозом. Они обнаружили замещение серина на аргинин в тетрамерной структуре инсулинового рецептора. Данная мутация в активном локусе приводила к невозможности соединения a- и b-субъединиц, в результате чего функционально активный рецептор не синтезировался. Приведенные исследования - лишь первые попытки выявления специфической генетической этиологии стромального текоматоза яичников.
Позднее Dunaif A. отмечает, что при синдроме поликистозных яичников ИР может быть обусловлена нарушением аутофосфорилирования b-субъединиц инсулинового рецептора (иР), цитоплазматическая часть которых обладает тирозинкиназной активностью. При этом повышается инсулиннезависимое фосфорилирование остатков серина (СПЯ-ser) с подавлением активности тирозинкиназы (вторичный передатчик сигнала, определяющий чувствительность инсулина к одноименным рецепторам). Данный дефект характерен только для СПЯ-зависимой ИР, при других инсулинорезистентных состояниях (ожирение, ИНСД) эти изменения не выявляются .
Нельзя исключить, что при СПЯ-ser существует некий серинфосфорилирующий фактор. Так, например, выделяют ингибитор серин/треонинфосфатазы, который, по-видимому, и нарушает фосфорилирование иР при СПЯ-ser. Данное соединение схоже с недавно выделенным мембранным гликопротеидом РС-1 (ингибитор тирозинкиназы инсулинового рецептора), но последний не увеличивает инсулиннезависимое фосфорилирование серина иР.
Подобными свойствами обладает и фактор некроза опухоли-a (ФНО-a): фосфорилирование остатков серина IRS-1 (один из вторичных передатчиков сигнала иР) под влиянием ФНО-a влечет за собой подавление тирозинкиназной активности иР.
Moller et al. обнаружили, что фосфорилирование серина Р450с17 человека, ключевого фермента, регулирующего биосинтез надпочечниковых и овариальных андрогенов, повышает 17,20-лиазную активность. Модулирование энзимной активности стероидогенеза за счет фосфорилирования серина было описано для 17b-гидроксистероиддегидрогеназы. Если предположить, что один и тот же фактор (энзим) фосфорилирует серин инсулинового рецептора, вызывая ИР, и серин Р450с17, вызывая гиперандрогению, то тогда можно объяснить взаимосвязь СПЯ и ИР. В экспериментах in vitro было показано, что протеинкиназа А (серин/треонинкиназа) катализирует фосфорилирование серина инсулиновых рецепторов (схема 4).

Схема 4. Ген инсулинорезистентности при СПЯ
Роль лептина при СПЯВ последнее время проводился ряд исследований, посвященных биологической роли лептина, результаты которых обнадеживают. Являясь протеиновым гормоном, лептин влияет на пищевое поведение и оказывает пермиссивное действие в отношении инициации полового созревания у животных. Роль данного гормона в регуляции метаболизма и репродуктивной функции у человека, к сожалению, окончательно не выяснена. По этой причине данные об уровне лептина при овариальной гиперандрогении в сочетании с инсулинорезистентностью и представления о его роли в развитии этих изменений весьма противоречивы.
В последнее время проводился ряд исследований, посвященных биологической роли лептина, результаты которых обнадеживают. Являясь протеиновым гормоном, лептин влияет на пищевое поведение и оказывает пермиссивное действие в отношении инициации полового созревания у животных. Роль данного гормона в регуляции метаболизма и репродуктивной функции у человека, к сожалению, окончательно не выяснена. По этой причине данные об уровне лептина при овариальной гиперандрогении в сочетании с инсулинорезистентностью и представления о его роли в развитии этих изменений весьма противоречивы.Так, согласно результатам исследования, проведенного Brzechffa et al. (1996), значительная часть женщин в популяции с СПЯ имеет уровень лептина выше, чем ожидалось с учетом их ИМТ, свободного тестостерона, чувствительности к инсулину. С другой стороны, последние работы в этой области не показали существенных различий уровней лептина в исследуемых группах при СПЯ и в группах контроля. Кроме того, было установлено, что на содержание лептина не оказывают влияние базальный уровень инсулина, содержание гонадотропинов и половых стероидов. Однако Zachow и Magffin (1997), принимая во внимание данные о наличии мРНК рецепторов лептина в овариальной ткани, продемонстрировали прямое действие указанного гормона на стероидогенез клеток гранулезы крыс in vitro. При этом было показано дозозависимое подавляющее действие лептина на ИФР-1, потенцированное увеличением ФСГ-стимулированного синтеза Е 2 клетками гранулезы. Эти данные подтверждают гипотезу о том, что повышение уровня лептина у лиц с ожирением может противодействовать созреванию доминантного фолликула и овуляции. Весьма интересными являются данные Spicer и Franciso (1997), свидетельствующие о том, что лептин в нарастающих концентрациях (10-300 нг/мл) ингибирует инсулинзависимую продукцию Е 2 и прогестерона в культуре клеток гранулезы. Этот эффект обусловлен наличием специфических сайтов связывания для лептина. По аналогии с этим можно предположить, что высокий уровень лептина может снижать чувствительность у других тканей-мишеней к действию эндогенного инсулина, приводя к развитию ИР при ожирении.
Диагноз
Диагностика синдрома овариальной гиперандрогении при типичной клинической картине не представляет трудностей. Прежде всего это нарушение менструальной функции по типу олиго-, опсо- или аменореи, ановуляция и обусловленное ею первичное или вторичное бесплодие, гирсутизм, угревая сыпь, у 40% больных имеется ожирение различной степени выраженности. При гинекологическом осмотре выявляется двухстороннее увеличение размеров яичников, нередко на фоне гипопластичной матки.
Важное место в диагностике СПЯ занимают гормональные методы исследования , направленные на выявление гиперандрогении, ее источника и определение уровня гонадотропных гормонов: ЛГ и ФСГ. У больных с СПЯ часто встречается преобладание уровня ЛГ над ФСГ, соотношение их нарушено и увеличено (больше 2,5-3). Уровень пролактина нормальный, хотя у 30% больных наблюдается его некоторое повышение.
Уровень экскреции с мочой суммарных 17-КС при СПЯ колеблется в широких пределах и мало информативен. Определение фракций 17-КС (ДГА, 11-окисленных кетостероидов, андростерона, этиохоланолона) также не обеспечивает выявление локализации источника гиперандрогении . Подтверждением овариального источника гиперандрогении является повышение уровня андростендиона (А) и тестостерона (Т) крови и повышение соотношения А/Т. Надпочечниковый генез гиперандрогении подтверждается при повышении уровня дегидроэпиандростерона (ДГА) и его сульфата (ДГА-С) и 17-оксипрогестерона (17-ОН-Р) в крови. Для уточнения локализации источника гиперандрогении предложены различные функциональные тесты, наибольшее распространение из которых получили проба с дексаметазоном, синактеном-депо.
С учетом открытия новых патогенетических звеньев в развитии СПЯ для оценки состояния углеводного обмена необходимо проводить стандартный глюкозо-толерантный тест (75 мл глюкозы per os) с определением уровня глюкозы и иммуно-реактивного инсулина (ИРИ). Свидетельством в пользу инсулинорезистентности являются также ИМТ более 25 и ОТ/ОБ больше 0,85, а также дислипидемия.
Лечение
В основе современного подхода к патогенетическому лечению СПЯ лежит принцип восстановления нарушенной функции яичников
, то есть устранение ановуляции, что в свою очередь приводит к снижению гиперандрогении и восстановлению фоликулогенеза. Однако изучение особенностей этиопатогенеза овариальной гиперандрогении приводит к заключению, что выбор методов адекватного лечения СПЯ оказывается непростой задачей.
Комбинированные оральные контрацептивы - наиболее часто используемая при СПЯ группа препаратов. Механизм действия заключается в подавлении повышенного ЛГ, нормализации соотношения ЛГ/ФСГ, повышении синтеза печенью СССГ. После отмены достигается “ребаунд-эффект”, заключающийся в нормализации гипоталамо-гипофизарной функции, снижении гиперпродукции андрогенов овариальной тканью, нормализации фолликулогенеза и восстановлении овуляции.
Лечение проводится по стандартной схеме: по 1 таблетке в день с 5 по 25 день цикла в течение 3-6 месяцев. При необходимости курсы повторяют. Однако известно, что длительный прием эстроген-гестагенных контрацептивов может привести к гиперинсулинемии, усугубляя тем самым основное патогенетическое звено СПЯ.
Некоторые контрацептивы имеют в своем составе гестагенные компоненты производные 19-норстероидов (норэтистерон, левоноргестрел), обладающих в разной степени андрогенными эффектами, в связи с чем назначение препаратов, содержащих эти компоненты, у больных с гирсутизмом ограничено. Более целесообразно при симптомах гиперандрогении использовать оральные контрацептивы с гестагеном без андрогенного действия.
Возможно применение гестагенных препаратов, лишенных андрогенных свойств в виде монотерапии, особенно при гиперплазии эндометрия. Дидрогестерон назначают по 1 таблетке (10 мг) 2 раза в день с 14-16 по 25 день цикла продолжительностью от 3 до 6 курсов.
Наиболее эффективным средством стимуляции овуляции при СПЯ является антиэстрогенный препарат кломифенцитрат . Основными эффектами антиэстрогенов являются снижение гиперсенсибилизации гипофиза к действию ГнРГ, снижение продукции ЛГ, индукция овуляторного выброса ЛГ, стимуляция овуляции. Препарат назначается по 50 мг, 100 мг в сутки с 5 по 9 день цикла до достижения овуляции по тестам функциональной диагностики, но не более 3-х курсов подряд. В последнее время появились публикации о влиянии кломифенцитрата на систему инсулин-инсулиноподобный фактор роста. В них указывалось, что к 5 дню проводимой стимуляции овуляции кломифеном (150 мг/сут) определялось прогрессивное снижение (максимально на 30%) уровня ИФР-1. Однако в ряде других аналогичных исследований достоверного снижения базального уровня инсулина в ответ на введение кломифена не было обнаружено.
Появление препаратов с антиандрогенными свойствами значительно расширило терапевтические возможности при СПЯ. Наиболее широко применяется препарат Диане-35, содержащий 35 мг этинилэстрадиола и 2 мг ципротерона ацетата. Кроме действия, характерного для оральных контрацептивов, препарат блокирует действие андрогенов на уровне клеток-мишеней, в частности, волосяных фолликулов. Последнее приводит к уменьшению гирсутизма. Препарат применяют по стандартной схеме, как оральный контрацептив курсами по 6 и более циклов. Однако нужно отметить наличие отрицательного эффекта этих препаратов на липидный и углеводный обмены, проявляющегося в повышении уровня холестерина, липопротеидов низкой плотности, а также в увеличении гиперинсулинемии, что требует постоянного динамического контроля за этими показателями у пациенток с СПЯ. Антиандрогенными свойствами обладают также спиронолактон, который широко применяется в лечении андрогензависимых дермопатий.
Одним из основных направлений в современной терапии овариальной гиперандрогении является поиск и применение препаратов и средств, направленных на устранение инсулинорезистентности и компенсаторной гиперинсулинемии.
Прежде всего это мероприятия, обеспечивающие снижение избыточной массы тела: низкокалорийная диета (в пределах 1500-2200 ккал/сут) с ограничением жиров и легко усваиваемых углеводов, ограничение потребления соли до 3-5 г в сутки, занятия умеренной физической нагрузкой, нормализация режима труда и отдыха. Возможно применение препаратов, способствующих снижению ИМТ, например, орлистата, селективно угнетающего желудочно-кишечные липазы (“блокатор жира”) или сибутрамина, блокирующего обратный захват норадреналина и серотонина в синапсах гипоталамического центра “насыщения”. Увеличенный расход энергии (термогенез) также обусловлен синергическим взаимодействием между усиленной функцией норадреналина и серотонина в центральной нервной системе. Это выражается в селективной активации центрального симпатического воздействия на бурую жировую ткань за счет непрямой активации b 3 -адренорецепторов.
Следующим этапом является применение препаратов, улучшающих нарушенную чувствительность тканей к действию инсулина. В литературе имеются данные о снижении гиперандрогении и восстановлении менструальной и овуляторной функции при назначении препаратов ряда бигуанидов (метформин /Сиофор®/, “Берлин-Хеми”). Они потенцируют действие инсулина на рецепторном и пострецепторном уровне и значительно улучшают чувствительность тканей к данному гормону. В некоторых исследованиях показано значительное снижение уровня инсулина натощак и через 2 часа после нагрузки 75 г глюкозы у женщин с СПЯ, применявших метформин. Это снижение коррелировало со снижением уровня андрогенов. Необходимо отметить также, что применение бигуанидов, нормализующих углеводные нарушения, нередко приводит к снижению ИМТ у пациенток с ожирением и положительно влияет на липидный обмен.
В мировой литературе сообщаются результаты применения препаратов, относящихся к классу тиазолидиндионов. Исследования показали, что на фоне лечения троглитазоном (200-400 мг/сут) улучшается чувствительность к инсулину у женщин с СПЯ, снижается уровень андрогенов. Однако выявленное цитотоксическое, гепатотоксическое действие этой группы препаратов ограничивает возможность их широкого применения. Ведется поиск новых препаратов, избирательно влияющих на чувствительность к инсулину.
Несмотря на значительный арсенал различных средств, применяемых для лечения овариальной гиперандрогении, терапия данной патологии должна быть комплексной и последовательной, учитывающей ведущее патогенетическое звено на данном этапе лечения.
Лечение женщин с СПЯ должно быть направлено не только на коррекцию выявленных симптомов этого заболевания, но и на профилактику возможных будущих осложнений. Очень важным является подавление избыточной секреции андрогенов и индуцирование стабильности ежемесячных менструальных кровотечений, что радежно достигается при применении препаратов с антиандрогенными свойствами (Диане-35).
В случае неэффективности консервативной терапии через год можно ставить вопрос об оперативном лечении - лапароскопии с клиновидной резекцией яичников или их лазерной вапоризацией . Эффективность хирургического лечения высокая (до 90-95% восстановления овуляции), а предварительная патогенетическая терапия повышает стабильность достигнутого результата.
Литература:1. Овсянникова Т.В., Демидова И.Ю., Глазкова О.И. Проблемы репродукции, 1998; 6: 5-8.
2. Гинзбург М.М., Козупица Г.С. Проблемы эндокринологии, 1997; 6: 40-2.
3. Старкова Н.Т. Клиническая эндокринология. Руководство для врачей, 1991; 399.
4. Givens J.R., Wiedeme E. B-endorphine and B-lipotropin levels in hirsute women: correlation with body weight. J Clin Endocr Metabol. 1980; 50: 975-81.
5. Aleem F.A., McIntosh T. Elevated plasma levels of f-endorph in a group of women with polycystic ovarian desease. Fertil and Steril. 1984; 42: 686-9.
6. Дедов И.И., Сунцов Ю.И., Кудрякова С.В. Проблемы эндокринологии. 1998; 6: 45-8.
7. Francis S., Greenspan, Forshman P.H. Basic and clinical endocrinology. 1987.
8. Акмаев И.К. Проблемы эндокринологии. 1990; 12-8.
9. Barbieri R.L., Hornstein M.D. Hyperinsulinemia and ovarian hyperandrogenism: cause and effect. Endocrinol Metab Clin North Am. 1988; 17: 685-97.
10. Barbieri R.L., Macris A., Ryan K.J. Insulin stimulates androgen accumulation in incubation of human ovarian stroma and theca. Obstet Gynecol. 1984; 64: 73-80.
11. Barbieri R.L., Ryan K.J. Hyperandrogenism, insulin resistence, acantosis nigricans: a common endocrinopathy with unique pathophysiologic features. Am J Obstet Gynecol. 1983; 147: 90-103.
12. Barbieri R.L., Smith S., Ryan K.J. The role of Hyperinsulinemia in the pathogenesis of ovarian Hyperandrogenism. Fertil and Steril. 1988; 50: 197-210.
13. Stuart C.A., Prince M.J., Peters E.J. Obstet Gynecol. 1987; 69: 921-3.
14. Yen S.S.C. Chronic anovuletion causet by peripheral endocrine disorders. In: Yen S.S.C., Jaffe R.B. Reproductive endocrinology: physiology, pathophysiology, and clinical managment. Philadelphia: Saunders W.B. 1986; 462-87.
15. Moller D.E., Flier J.S. Detection of an alteration in the insulin-reseptor gene in a patient with insulin resistance, acantosis nigricans and polycystic ovarian syndrome. N Engl J Med. 1988; 319: 1526-32.
16. Burgen G.A., Givens J.R. Insulin resistance and hyperandrogenism: clinical syndromes and possible mechanisms. Hemisphera Pablishing CO, Washington, DC. 1988; 293-317.
17. Speroff L., Glass R. H. Clinical gynecologic. Endocrinology and Infertiliti 5 th ed. 1994.
18. Yoshimasa Y., Seino S., et al. Insulin resistance diabetes due to a point mutacion that privents insulin proreceptor processing./ Science. 1988; 240: 784-9.
19. Dunaif A. Endocrin. Rev., 18(6): 1997; 12: 774-800.
Этинилэстрадиол + ципротерона ацетат
Диане-35 (торговое название)
(Shering AG)
Гиперандрогения - повышение концентрации мужских половых гормонов у женщин. Гиперандрогенные расстройства можно объяснить чрезмерной секрецией андрогенов яичниками или надпочечниками.
Общие симптомы гиперандрогении
Характерные признаки гиперандрогении могут варьировать от умеренного нежелательного излишнего оволосения и акне до алопеции (облысения), чрезмерного гирсутизма, маскулинизации и вирилизации. Гирсутизм характеризуется оволосением, подобным мужскому, что связано с преобразованием пушковых волос в терминальные в таких областях, как лицо, грудь, живот, верхняя часть бедер. К признакам маскулинизации относят потерю жира в организме женщины и уменьшение размера груди. Вирилизация заключается в присоединении височного облысения, снижении тембра голоса и увеличении клитора в ответ на любое предшествующее избыточное влияние мужского гормона при гиперандрогении у женщин.
Гиперандрогенные расстройства делят на функциональные и неопластические расстройства надпочечников или яичников.
Причины гиперандрогении
- Болезни надпочечников: гиперплазия надпочечников; синдром Кушинга; аденома, карцинома надпочечников.
- Болезни яичников: поликистоз яичников; HAIR-AN-синдром.
- Опухоли яичников: клеток Сертоли-Лейдига; хилусных клеток; опухоли липоидных клеток.
- Идиопатический гирсутизм.
Врожденная гиперплазия надпочечников
ВГН - общее понятие, используемое для описания различных расстройств, возникающих вследствие врожденной ферментной недостаточности надпочечников, сопровождающихся сверхсинтезом стероидов. Наиболее распространенная причина ВГН - дефицит 21-гидроксилазы. ВГН представлена спектром расстройств, начиная с тяжелых форм солевого истощения до вирилизации и неклассической ВГН. И солевое истощение, и простую вирилизацию называют классическими формами гиперандрогении у женщин, поскольку их симптомы (например, потеря соли или гермафродитные гениталии у новорожденных девочек) заметны при рождении или возникают вскоре после него. С другой стороны, существует неклассическая форма, называемая поздно наступившей обычно манифестирующая при половом созревании или позднее. У таких пациентов отсутствуют аномалии гениталий при гиперандрогении, но могут развиться гирсутизм, акне, а также овуляторные и менструальные расстройства.
Поскольку 21-гидроксилаза отвечает за превращение 17-гидроксипрогестерона в 11-дезоксикортизол, ее дефицит приводит к чрезмерному накоплению 17-гидроксипрогестерона. В результате обнаруживают повышение 17-гидроксипрогестерона в крови, а также усиление синтеза андростендиона и тестостерона в Д4-метаболическом пути. Заболевание гиперандрогенией наследуется по аутосомно-рецессивному типу.
Синдром Кушинга
Другое серьезное заболевание надпочечников, приводящее к чрезмерной продукции андрогена и гиперандрогении, - синдром Кушинга, или стойкий гиперкортицизм. К характерным кушингоидным признакам относят ожирение туловища, лунообразное лицо, артериальную гипертензию, склонность к образованию синяков, нарушение толерантности к глюкозе, потерю мышечной массы, остеопороз, стрии на коже живота, отложение жира в надключичной области и на задней поверхности шеи. Возможно обнаружение других признаков: гирсутизма, акне, нерегулярных менструаций. Указанное расстройство может развиваться при кортизолпродуцирующей опухоли надпочечников или АКТГ-продуцирующей аденоме гипофиза (болезни Кушинга). Оно может быть редкой причиной нарушения менструальной функции при гиперандрогении у женщин.
Опухоли надпочечников
Опухоли надпочечников, приводящие к гиперандрогении, при отсутствии симптомов и признаков избытка глюкокортикоидов возникают крайне редко. Аденомы, синтезирующие только андрогены, как правило, выделяют большое количество ДГЭАС. Карцинома надпочечников может синтезировать большое количество глюкокортикоидов.
Синдром поликистозных яичников
Около 6% женщин репродуктивного возраста страдают СПКЯ. Это хроническое заболевание, характеризующееся ановуляцией либо олигоовуляцией с клиническими или лабораторными признаками гиперандрогении, а также отсутствием симптомов какого-либо другого патологического состояния. Как правило, оно развивается при половом созревании. Существует наследственная предрасположенность к возникновению СПКЯ. У родственниц первого поколения вероятность развития СПКЯ увеличена.
Наиболее распространенные симптомы СПКЯ: гирсутизм (90%), менструальные нарушения (90%) и (75%). Возникновение гирсутизма у женщин, использовавших комбинированные гормональные контрацептивы на протяжении большей части своей жизни, и женщин азиатского происхождения менее вероятно. Многие пациентки с СПКЯ страдают абдоминальным ожирением, распространенность гиперандрогении широко варьирует в зависимости от страны происхождения женщины. В США отмечают самую высокую распространенность ожирения среди женщин, страдающих СПКЯ (около 60%).
В яичниках большинства больных обнаруживают множество неактивных фолликулярных кист с задержкой развития фолликулов на срединно-антральной стадии. Кисты локализуются в периферической части коркового слоя яичника. Строма яичников гиперплазирована и обычно содержит островки лютеинизированных тека-клеток, продуцирующих андрогены. Приблизительно у 20% женщин с нормальным гормональным статусом также можно обнаружить поликистоз яичников.
Гиперандрогения у женщин при СПКЯ возникает в результате избыточного синтеза мужских половых гормонов яичниками и часто надпочечниками. Патофизиологические основы гиперандрогении при СПКЯ неизвестны. У больных обнаруживают повышенную частоту выброса лютропина, обычно приводящую к увеличению концентрации этого гормона в кровотоке. Вероятно, это связано с повышением секреции ГнРГ гипоталамусом и увеличением чувствительности к нему гипофиза.
Подъем содержания лютропина способствует секреции андрогенов тека-клетками, что повышает концентрацию вырабатываемых яичником андростендиона и тестостерона. Это, в свою очередь, вызывает атрезию многих развивающихся фолликулов и часто препятствует развитию доминантного или преовуляторного фолликула. Превращение андрогенов в эстрогены при гиперандрогении на периферии приводит к повышению концентрации эстрогенов (по сравнению с таковым в начале фолликулярной фазы), подавляющему высвобождение ФСГ из гипофиза. Все это вызывает нарушение нормального функционирования яичника, поэтому в середине цикла не происходит выброса лютропина и возникает ановуляция при гиперандрогении у женщин. У некоторых пациенток, страдающих СПКЯ, обнаруживают избыточный синтез андрогенов и надпочечниками, и яичниками. Механизм развития избыточной продукции андрогенов надпочечниками при СПКЯ неизвестен.
При СПКЯ существует взаимосвязь между аномальной продукцией андрогенов, инсулинорезистентностью и гиперинсулинемией. Примерно у 60-70% больных СПКЯ снижается чувствительность к инсулину, возникает его гиперсекреция. Гиперинсулинемия связана с прямой стимуляцией продукции инсулина тека-клетками, что приводит к секреции андрогенов. Повышение концентрации андрогенов и инсулина при СПКЯ также способствует снижению синтеза печенью глобулина, связывающего половые гормоны, и его секреции. При этом содержание свободного тестостерона может значительно увеличиваться, хотя повышение концентрации общего тестостерона будет умеренным или незначительным. Таким образом, выраженность соматических симптомов гиперандрогении при СПКЯ зависит от содержания общего тестостерона.
В долгосрочной перспективе инсулинорезистентность, связанная с СПКЯ, может привести к увеличению риска метаболического синдрома при гиперандрогении у женщин (диабета и болезней сердца). Действие эстрогенов при гиперандрогении может привести к гиперплазии эндометрия, а иногда и к его раку.
Диагноз СПКЯ продолжает оставаться несколько сомнительным в связи с несогласованностью диагностических критериев. СПКЯ считают диагнозом исключения. Кроме того, это синдром, а не особая и легко диагностируемая болезнь. Европейское сообщество человеческой репродукции и эмбриологии определяет СПКЯ как синдром, при котором у пациентов отмечают нерегулярную овуляцию, обычно сопровождающуюся олигоменореей, гиперандрогению или поликистоз яичников при исключении других причин развития этих симптомов.
Гиперандрогенная инсулинорезистентность с синдромом черного акантоза
Гиперандрогения с синдромом черного акантоза (HAIR-AN-синдром) - наследственное гиперандрогенное заболевание, характеризующееся тяжелой инсулинорезистентностью, отличной от таковой при СПКЯ. При HAIR-AN-синдроме обнаруживают чрезвычайно высокую концентрацию циркулирующего инсулина (базальное содержание - более 80 МЕ/мл, после приема внутрь глюкозы - более 500 МЕ/мл), связанную с тяжелой инсулинорезистентностью. Поскольку инсулин - гормон, обладающий митогенной активностью, его крайне высокое содержание приводит к гиперплазии базального слоя эпидермиса кожи, что вызывает развитие черного акантоза - гиперпигментации складок кожи. Кроме того, в результате действия инсулина на тека-клетки яичников у многих больных HAIR-AN-синдромом обнаруживают их гиперплазию. У пациенток с этим заболеванием возможно развитие тяжелой гиперандрогении и даже вирилизации. Кроме того, эти женщины подвергаются значительному риску развития дислипидемии, диабета 2-го типа, артериальной гипертензии, сердечно-сосудистых заболеваний. Таких больных особенно трудно лечить, хотя перспективным считают использование длительно действующих аналогов ГнРГ.
Новообразования яичников
Андрогенпродуцирующие опухоли яичников регистрируют примерно у одной из 500 женщин, страдающих гирсутизмом. В их состав входят клетки Сертоли-Лейдига, хилусные и липоидные клетки. Вирилизация при гиперандрогении сопровождается гиперплазией стромы окружающих негормонпродуцирующих новообразований яичника. К таким опухолям относят кистозные тератомы, опухоли Бреннера, серозные цистаденомы и опухоли Крукенберга.
Идиопатический гирсутизм
У некоторых женщин гирсутизм выражен в легкой или средней степени и не сопровождается повышением концентрации андрогенов в крови. Это состояние называют идиопатическим гирсутизмом, также ошибочно обозначают термином «конституциональный гирсутизм». Идиопатический гирсутизм при гиперандрогении у женщин может развиваться из-за усиления тканевого превращения тестостерона в биологически более активный ДГТ. Почти все заболевания, приводящие к гирсутизму (например, СПКЯ, HAIR-AN-синдром или ВГН), имеют наследственное происхождение. Истинный гирсутизм редко бывает конституциональным и почти всегда указывает на преимущественно андрогенное расстройство у женщин.
Диагностика
Анамнез: функциональные расстройства, такие как СПКЯ или поздно наступившая ВГН, обычно впервые возникают во время периода полового созревания и имеют тенденцию к медленному прогрессированию. При подобных расстройствах симптомы избыточного влияния андрогенов развиваются через несколько лет. В отличие от них, опухолевые заболевания могут возникать в любое время. Чаще они развиваются после достижения половой зрелости и начинаются внезапно. Гиперандрогения прогрессирует стремительными темпами, и зачастую этому предшествует вирилизация. Иногда регистрируют сочетание с функциональными расстройствами. Так, у 15% пациентов с HAIR-AN-синдромом обнаруживают симптомы вирилизации при гиперандрогении, в частности тяжелый гирсутизм, височное облысение и даже некоторое увеличение клитора.
Физикальное обследование
Следует оценить степень выраженности гиперандрогении, гирсутизма, акне или андрогенной алопеции и пропальпировать щитовидную железу. Пациентов следует активно расспрашивать о чрезмерном оволосении лица, поскольку они могут скрывать гирсутизм, регулярно делая эпиляцию, и стесняться добровольно предоставить информацию. Следует обращать внимание на кушингоидные признаки. Черный акантоз часто указывает на инсулинорезистентность и гиперинсулинемию. С помощью бимануального гинекологического исследования можно обнаружить увеличение яичников при гиперандрогении у женщин. Асимметричное увеличение, связанное с резким наступлением вирилизации, может свидетельствовать о редкой андрогенпродуцирующей опухоли.
Лабораторные обследования при гиперандрогении
Лабораторное исследование у пациентов с вирилизацией и/или выраженным гирсутизмом выполняют главным образом в целях исключения серьезных заболеваний.
Измерение базальной концентрации 17-гидроксипрогестерона позволяет исключить недостаточность 21-гидроксилазы при ВГН. При содержании этого гормона более 2 нг/мл АКТГ-стимуляционный тест, при котором определяют концентрацию 17-гидроксипрогестерона, считают основным методом диагностики. При подозрении на синдром Кушинга следует провести либо измерение суточного содержания свободного кортизола в моче, либо супрессивную пробу с дексаметазоном. Последний тест при гиперандрогении заключается в приеме внутрь на ночь дексаметазона в дозе 1 мг с последующим определением натощак в 8 ч утра концентрации кортизола в крови (нормальный показатель - менее 5 г/дл).
Измерение содержания пролактина и ТТГ позволяет исключить гиперпролактинемию и дисфункцию щитовидной железы. Для пациентов с неявными признаками гиперандрогении может быть полезной оценка концентрации общего и свободного тестостерона, ДГЭАС в крови. Содержание ДГЭАС более 7000 нг/мл или общего тестостерона свыше 200 нг/дл дает основание заподозрить андрогенпродуцирующую опухоль надпочечников или яичников. Тем не менее наилучшим показателем этого заболевания, насколько бы редким оно не было, служат клинические симптомы. Признаки вирилизации присутствуют у 98% больных с опухолями независимо от концентрации тестостерона при гиперандрогении у женщин.
Органов малого таза для исключения опухоли яичника следует выполнять при любых факторах риска. Андрогенпродуцирующие опухоли надпочечников можно обнаружить с помощью КТ или МРТ. Если клинические или лабораторные результаты свидетельствуют об андрогенпродуцирующей опухоли при гиперандрогении и ее локализацию невозможно определить с помощью томографических методов исследования, проводят селективную венозную катетеризацию и измерение концентрации андрогенов в венозной крови от каждого надпочечника и яичника.
У больных, страдающих СПКЯ и HAIR-AN-синдромом, следует оценивать метаболический статус. Хотя измерения содержания глюкозы при гиперандрогении достаточно для массового обследования на диабет, у больных с СПКЯ для тщательной проверки следует определить толерантность к глюкозе. У лиц старше 35 лет, молодых пациентов с признаками метаболических нарушений (например, с HAIR-AN-синдромом), следует определять концентрацию липидов в крови.
Лечение
При выборе лечения гиперандрогении следует руководствоваться этиологией заболевания, тяжестью клинических симптомов и желанием пациента. В редких случаях при опухоли яичников или надпочечников рекомендуют ее удаление хирургическим путем. У женщин в пременопаузе при опухоли яичника достаточно односторонней сальпингоовариэктомии (удаления яичника с маточной трубой), что позволяет сохранить детородную функцию. Лечение женщин в постменопаузе состоит в тотальной абдоминальной гистерэктомии и двусторонней сальпингоовариэктомии. У пациенток с синдромом Кушинга проводят хирургическое удаление источника(опухоли надпочечников или гипофиза), избыточно продуцирующего кортизол или АКТГ.
Безусловно, СПКЯ - наиболее распространенное функциональное заболевание яичников, вызывающее гиперандрогению, и тактика ведения СПКЯ зависит от описания заболевания пациентом и его желания. Лечение гирсутизма у больных с СПКЯ заключается в подавлении функции яичников. Обычно этого достигают приемом комбинированных ОК. При лечении эстрогенами и прогестероном происходит подавление высвобождения гонадотропинов (ФСГ и лютропина), что способствует уменьшению гиперпродукции тестостерона и андростендиона яичниками. Эстрогены также стимулируют синтез глобулина, связывающего половые гормоны, что снижают концентрацию свободного тестостерона.
Для эффективного лечения гирсутизма при гиперандрогении дополнительно назначают блокаторы андрогенов. Спиронолактон - наиболее часто используемый препарат для лечения гиперандрогении и гирсутизма у женщин в США. Этот антагонист альдостерона конкурентно связывается с тестостероном, оказывая прямой антиандрогенный эффект на ткани-мишени. Кроме того, спиронолактон влияет на стероидные ферменты и снижает производство тестостерона. Поскольку этот препарат от гиперандрогении у женщин - антагонист альдостерона, возможно повышение концентрации калия в крови. К другим препаратам, блокирующим связывание андрогенов с их рецепторами, относят флутамид и ципротерон, тогда какфинастерид угнетает превращение тестостерона в его более активный метаболит - ДГТ. Для достижения косметического улучшения может потребоваться до 6 мес, а максимальный эффект развивается в течение двух лет.
Подавление избыточного производства андрогенов или их действия обычно препятствует дальнейшему росту волос, но причина, вызывающая гирсутизм, исчезает не сразу. Для получения хорошего косметического результата при гиперандрогении обычно требуется удаление нежелательных волос на некоторых участках в сочетании с биохимическим лечением. Местные методы при гиперандрогении включают бритье, применение крема для удаления волос, электролиз и лазерное удаление волос. Удалять отдельные волоски не следует, так как это может стимулировать развитие окружающих волосяных фолликулов.
Все пациентки, страдающие гиперандрогенией, СПКЯ и хронической ановуляцией, подвергаются риску рака эндометрия. Именно поэтому при лечении женщин, не принимающих комбинированные ОК, следует всегда планировать отмену приема прогестининдуцирующих средств для защиты эндометрия и снижения риска. В этих целях рекомендуют прием внутрь медроксипрогестерона в дозе 10 мг ежедневно, микронизированного прогестерона по 100 мг 2 раза/день или норэтиндрона 5 мг ежедневно 12-14 дней через месяц.
Инсулинорезистентность и гиперандрогения у многих пациенток, страдающих СПКЯ, могут влиять на риск диабета и, возможно, сердечно-сосудистых заболеваний. У женщин с СПКЯ отмечают тенденцию к повышению холестерина. Кроме того, у них высок риск развития артериальной гипертензии при гиперандрогении. Таким образом, пациенткам с СПКЯ и хронической ановуляцией следует давать рекомендации по снижению массы тела, питанию, физической активности и другим изменениям образа жизни, что позволит снизить риск диабета.
Пациенткам с функциональной надпочечниковой гиперандрогенией (например, с ВГН) назначают глюкокортикоиды (например, дексаметазон 0,25 мг перед сном через день). Многим из этих женщин также требуются препараты, подавляющие секрецию андрогенов яичниками. Для этого назначают комбинированные ОК и антиандрогены.
Статью подготовил и отредактировал: врач-хирургГиперандрогения – общее обозначение ряда эндокринных патологий разной этиологии, характеризующихся чрезмерной продукцией мужских гормонов – андрогенов в организме женщины или повышенной восприимчивостью к стероидам со стороны тканей-мишеней. Чаще всего гиперандрогения у женщин впервые диагностируется в репродуктивном возрасте – от 25 до 45 лет; реже – у девочек в подростковом периоде.
Источник: klinika-bioss.ru
Для предотвращения гиперандрогенных состояний женщинам и девушкам-подросткам рекомендуются профилактические осмотры гинеколога и скрининговые тесты для контроля андрогенного статуса.
Причины
Гиперандрогения – проявление широкого спектра синдромов. Специалисты называют три наиболее вероятные причины гиперандрогении:
- повышение уровня андрогенов в сыворотке крови;
- превращение андрогенов в метаболически активные формы;
- активная утилизация андрогенов в тканях-мишенях вследствие аномальной чувствительности андрогенных рецепторов.
Чрезмерный синтез мужских половых гормонов, как правило, связан с нарушением функции яичников. Чаще всего встречается синдром поликистозных яичников (СПКЯ) – образование множественных мелких кист на фоне комплекса эндокринных расстройств, включая патологии щитовидной и поджелудочной железы, гипофиза, гипоталамуса и надпочечников. Заболеваемость СПКЯ среди женщин фертильного возраста достигает 5–10%.
Гиперсекреция андрогенов также наблюдается при следующих эндокринопатиях:
- адреногенитальный синдром;
- врожденная гиперплазия надпочечников;
- синдром галактореи-аменореи;
- стромальный текоматоз и гипертекоз;
- вирилизирующие опухоли яичников и надпочечников, продуцирующие мужские гормоны.
Гиперандрогения на почве трансформации половых стероидов в метаболически активные формы часто вызывается разнообразными нарушениями липидно-углеводного обмена, сопровождающихся инсулинорезистентностью и ожирением. Чаще всего наблюдается трансформация продуцируемого яичниками тестостерона в дигидротестостерон (ДГТ) – стероидный гормон, стимулирующий выработку кожного сала и рост стержневых волос на теле, а в редких случаях – потерю волос на голове.
Компенсаторная гиперпродукция инсулина стимулирует выработку клеток яичников, продуцирующих андрогены. Транспортная гиперандрогения наблюдается при нехватке глобулина, связывающего свободную фракцию тестостерона, что характерно для синдрома Иценко – Кушинга, дислипопротеидемии и гипотиреоза. При высокой плотности андрогенных рецепторов клеток тканей яичников, кожи, волосяных фолликулов, сальных и потовых желез симптомы гиперандрогении могут наблюдаться при нормальном уровне половых стероидов в крови.
Степень выраженности симптомов зависит от причины и формы эндокринопатии, сопутствующих заболеваний и индивидуальных особенностей.
Вероятность манифестации патологических состояний, ассоциированных с симптомокомплексом гиперандрогении, зависит от ряда факторов:
- наследственная и конституциональная предрасположенность;
- хронические воспалительные заболевания яичников и придатков;
- выкидыши и аборты, особенно в ранней молодости;
- нарушения обмена веществ;
- избыточная масса тела;
- вредные привычки – курение, злоупотребление алкоголем и наркотиками;
- дистресс;
- длительный прием лекарств, содержащих стероидные гормоны.
Идиопатическая гиперандрогения является врожденной или возникает в детстве либо в пубертатном периоде без видимых причин.
Виды
В гинекологической практике выделяют несколько типов гиперандрогенных состояний, которые отличаются друг от друга по этиологии, течению и симптоматике. Эндокринная патология может быть как врожденной, так и приобретенной. Первичная гиперандрогения, не связанная с другими заболеваниями и функциональными расстройствами, обусловлена нарушениями гипофизарной регуляции; вторичная выступает следствием сопутствующих патологий.
Исходя из специфики манифестации, различают абсолютную и относительную разновидности гиперандрогении. Абсолютная форма характеризуется повышением уровня мужских гормонов в сыворотке крови женщины и, в зависимости от источника гиперсекреции андрогенов, подразделяются на три категории:
- овариальная, или яичниковая;
- адреналовая, или надпочечниковая;
- смешанная – одновременно присутствуют признаки яичниковой и надпочечниковой форм.
Относительная гиперандрогения протекает на фоне нормального содержания мужских гормонов при избыточной чувствительности тканей-мишеней к половым стероидам или усиленной трансформации последних в метаболически активные формы. В отдельную категорию выделяют ятрогенные гиперандрогенные состояния, развившиеся в результате продолжительного приема гормональных препаратов.
Быстрое развитие признаков вирилизации у взрослой женщины дает основание заподозрить андроген-продуцирующую опухоль яичника или надпочечника.
Симптомы гиперандрогении
Клиническая картина гиперандрогенных состояний характеризуется большим многообразием проявлений, которые укладываются в стандартный комплекс симптомов:
- расстройства менструальной функции;
- нарушения обмена веществ;
- андрогенная дермопатия;
- бесплодие и невынашивание беременности.
Степень выраженности симптомов зависит от причины и формы эндокринопатии, сопутствующих заболеваний и индивидуальных особенностей. К примеру, дисменорея проявляется особенно ярко при гиперандрогении овариального генеза, которая сопровождается аномалиями развития фолликулов, гиперплазией и неравномерным отслоением эндометрия, кистозными изменениями в яичниках. Пациентки жалуются на скудные и болезненные менструации, нерегулярные или ановуляторные циклы, маточные кровотечения и предменструальный синдром. При синдроме галактореи-аменореи отмечается дефицит прогестерона.
Выраженные метаболические расстройства – дислипопротеидемия, инсулинорезистентность и гипотиреоз характерны для первичной гипофизарной и надпочечниковой форм гиперандрогении. Примерно в 40% случаях у пациенток обнаруживают абдоминальное ожирение по мужскому типу или с равномерным распределением жировой ткани. При адреногенитальном синдроме наблюдается промежуточное строение гениталий, а в самых тяжелых случаях – псевдогермафродитизм. Вторичные половые признаки выражены слабо: у взрослых женщин отмечается недоразвитие груди, понижение тембра голоса, увеличение мышечной массы и оволосение тела; для девочек характерно позднее менархе. Быстрое развитие признаков вирилизации у взрослой женщины дает основание заподозрить андроген-продуцирующую опухоль яичника или надпочечника.
Андрогенная дермопатия обычно связана с повышенной активностью дигидротестостерона. Воздействие гормона, стимулирующего секреторную активность кожных желез, изменяет физико-химические свойства кожного сала, провоцируя закупорку выводных протоков и воспаление сальных желез. В результате у 70–85% пациенток с гиперандрогенией присутствуют признаки акне – угревая сыпь, расширение кожных пор и комедоны.
Гиперандрогенные состояния – одна из самых распространенных причин женского бесплодия и невынашивания беременности.
Реже встречаются другие проявления андрогенной дерматопатии – себорея и гирсутизм. В отличие от гипертрихоза, при котором наблюдается избыточный рост волос по всему телу, гирсутизм характеризуется превращением пушковых волос в жесткие терминальные волосы в андрогеночувствительных зонах – над верхней губой, на шее и подбородке, на спине и груди вокруг соска, на предплечьях, голенях и внутренней стороне бедра. У женщин в период постменопаузы изредка отмечается битемпоральная и париетальная алопеция – выпадение волос на висках и в области темени соответственно.
Источник: woman-mag.ru
Особенности протекания гиперандрогении у детей
В допубертатном периоде у девочек могут проявиться врожденные формы гиперандрогении, обусловленные генетическими аномалиями или воздействием андрогенов на плод во время беременности. Гипофизарную гиперандрогению и врожденную гиперплазию надпочечников распознают по выраженной вирилизации девочки и аномалиями строения гениталий. При адреногенитальном синдроме могут присутствовать признаки ложного гермафродитизма: гипертрофия клитора, сращение больших половых губ и вагинального отверстия, смещение уретры к клитору и уретрогенитальный синус. Одновременно отмечаются:
- раннее зарастание родничков и эпифизарных щелей в младенчестве;
- преждевременное оволосение тела;
- быстрый соматический рост;
- замедленное половое созревание;
- позднее менархе или отсутствие менструаций.
Врожденная гиперплазия надпочечников сопровождается нарушениями водно-солевого баланса, гиперпигментацией кожи, гипотонией и вегетативными расстройствами. Начиная со второй недели жизни, при врожденной гиперплазии надпочечников и тяжелом течении адреногенитальном синдрома возможно развитие адреналового криза – острой надпочечниковой недостаточности, сопряженной с угрозой для жизни. Родителей должны насторожить резкое падение артериального давления до критической отметки, рвота, диарея и тахикардия у ребенка. В подростковом возрасте адреналовый криз могут спровоцировать нервные потрясения.
Умеренную гиперандрогению в подростковом возрасте, ассоциированную с резким ростовым скачком, следует дифференцировать с врожденным поликистозом яичников. Дебют СПКЯ зачастую происходит на этапе становления менструальной функции.
Врожденная гиперандрогения надпочечникового генеза у детей и девочек-подростков может внезапно осложниться адреналовым кризом.
Диагностика
Заподозрить гиперандрогению у женщины можно по характерным изменениям внешности и на основании данных анамнеза. Для подтверждения диагноза, определения формы и выявления причины гиперандрогенного состояния проводится анализ крови на андрогены – общий, свободный и биологически доступный тестостерон, дигидротестостерон, дегидроэпиандростерон-сульфат (ДЭА-сульфат), а также глобулин, связывающий половые гормоны (ГСПГ).
При гиперандрогенных состояниях адреналовой, гипофизарной и транспортной этиологии женщину направляют на МРТ или КТ гипофиза и надпочечников. По показаниям выполняют анализы крови на 17-оксипрогестерон и мочи на кортизол и 17-кетостероиды. Для диагностики обменных патологий применяются лабораторные исследования:
- пробы с дексаметазоном и хорионическим гонадотропином человека;
- определение уровня холестерина и липопротеидов;
- анализы крови на сахар и гликированный гликоген, тест на толерантность к глюкозе;
- пробы с адренокортикотропным гормоном.
Для улучшения визуализации железистой ткани при подозрении на новообразование показана МРТ или КТ с применением контрастных веществ.
Лечение гиперандрогении
Коррекция гиперандрогении дает стойкий результат только в рамках терапии основных заболеваний, таких как СПКЯ или синдром Иценко – Кушинга, и сопутствующих патологий – гипотиреоза, инсулинорезистентности, гиперпролактинемии и др.
Гиперандрогенные состояния яичникового генеза корректируют при помощи эстроген-гестагенных оральных контрацептивов, подавляющих секрецию овариальных гормонов и блокирующих андрогеновые рецепторы. При сильной андрогенной дермопатии выполняют периферическую блокаду рецепторов кожи, сальных желез и волосяных фолликулов.
В случае надпочечниковой гиперандрогении применяют кортикостероиды; при развитии метаболического синдрома дополнительно назначают инсулиновые синтетайзеры в сочетании с низкокалорийной диетой и дозированными физическими нагрузками. Андроген-секретирующие новообразования, как правило, имеют доброкачественную природу и не рецидивируют после удаления хирургическим путем.
Для женщин, планирующих беременность, лечение гиперандрогении служит обязательным условием восстановления репродуктивной функции.
Профилактика
Для предотвращения гиперандрогенных состояний женщинам и девушкам-подросткам рекомендуются профилактические осмотры гинеколога и скрининговые тесты для контроля андрогенного статуса. Раннее выявление и лечение гинекологических заболеваний, своевременная коррекция гормонального фона и грамотный подбор контрацептивов успешно профилактируют гиперандрогению и способствуют поддержанию репродуктивной функции.
При склонности к гиперандрогении и врожденных адренопатиях важно придерживаться здорового образа жизни и щадящего режима труда и отдыха, отказаться от вредных привычек, ограничить влияние стресса, вести упорядоченную половую жизнь, избегать абортов и средств экстренной контрацепции; категорически запрещен бесконтрольный прием гормональных препаратов и анаболических препаратов. Немаловажное значение имеет контроль массы тела; предпочтительна умеренная двигательная активность без тяжелых физических нагрузок.
Чаще всего гиперандрогения у женщин впервые диагностируется в репродуктивном возрасте – от 25 до 45 лет; реже – у девочек в подростковом периоде.
Последствия и осложнения
Гиперандрогенные состояния – одна из самых распространенных причин женского бесплодия и невынашивания беременности. Длительное течение гиперандрогении повышает риск развития метаболического синдрома и сахарного диабета II типа, атеросклероза, артериальной гипертензии и ишемической болезни сердца. По некоторым данным, высокая активность андрогенов коррелирует с заболеваемостью некоторыми формами рака груди и раком шейки матки у женщин, инфицированных онкогенными папилломавирусами. Кроме того, эстетический дискомфорт при андрогенной дермопатии оказывает на пациенток сильное психотравмирующее воздействие.
Врожденная гиперандрогения надпочечникового генеза у детей и девочек-подростков может внезапно осложниться адреналовым кризом. В силу возможности летального исхода при первых признаках острой надпочечниковой недостаточности следует немедленно доставить ребенка в больницу.
Видео с YouTube по теме статьи:
Гиперандрогения у женщин – это повышенное содержание мужских половых гормонов (тестостерона). Он является предшественником. Превращение идет под влиянием фермента ароматазы. Вырабатывается тестостерон у слабого пола в надпочечниках, яичниках и жировой ткани. «Поломка» на любом из этих уровней может привести к разным видам гиперандрогении у женщин.
Основные типы гиперандрогении у женщин
На сегодняшний момент в зависимости от причин происхождения гиперандрогении выделяют ее две основные формы. Это истинная и другие. К истинной относятся яичниковая и надпочечниковая гиперандрогения. По происхождению они могут быть функциональными и опухолевыми.
Функциональные истинные гиперандрогении у женщин и причины их вызывающие:
- Яичниковая гиперандрогения. Связана с дефицитом фермента ароматазы, который обеспечивает превращение тестостерона в эстрогены. Как правило, это врожденный дефект. Часто встречается слабовыраженная гиперандрогения яичникового генеза – стертые формы (уровень тестостерона может быть в норме, могут отсутствовать УЗИ-признаки склерокистозных яичников).
- Надпочечниковая гиперандрогения. Связана с недостатком фермента, превращающего предшественников тестостерона. Симптомы гиперандрогении надпочечникового генеза: характеризуются значительными повышенными уровнями тестостерона и как проявление этого – гирсутизм;
К другим формам относятся:
- Транспортная. Ассоциируется с дефицитом глобулина, связывающего половые гормоны (ГСПГ). Этот глобулин связывает и препятствует его попаданию в клетку органа-мишени. Вырабатывается ГСПГ в печени, его уровни зависят от работы щитовидной железы и количества эстрогенов.
- Метаболическая гиперандрогения. Связана с нарушением углеводного и жирового обмена. В основе лежит инсулинорезистенстность;
- Гиперандрогения смешанного генеза. Сочетание различных форм и причин, вызывающих синдром гиперандрогении у женщин;
- Ятрогенная. Возникает в результате действия различных медикаментов.

Основные симптомы гиперандрогении
Органы-мишени для действия тестостерона: яичники, кожные покровы, сальные и потовые, а также молочные железы, волосы. Ведущими симптомами гиперандрогении у женщин являются следующие проявления:
- (созревание и выхода яйцеклетки), которое может провоцировать бесплодие и приводить к гиперэстрогении. Длительно существующая гиперэстрогения является риском в гормон зависимых органах (матка, яичники);
- Инсулинорезистентность (нечувствительность тканей к инсулину, вследствие чего клетка не усваивает глюкозу и остается «голодной»). Приводит к развитию сахарного диабета второго типа;
- Гирсутизм. Признаки гиперандрогении в данном случае: рост волос в андрогенных зонах (на бороде, груди, передней брюшной стенке, руках, ногах, спине);
- Кожные проявления (акне, себорея, андрогензависимая алопеция)
- Склерокистозные яичники: увеличены в объеме, с плотной белочной оболочкой, но множеством созревающих фолликулов, расположенных по периферии. Создается симптом «ожерелья».
Диагноз гиперандрогении ставится на основании не менее двух из вышеперечисленных симптомов.
Диагностика гиперандрогении у женщин
Лечение гиперандрогении у женщин зависит от правильной диагностики причины и вида этого синдрома. Диагностика складывается из следующих этапов:
- Жалоб на повышенный рост волос в атипичных для женщин местах, появление акне, бесплодие, нарушение менструального цикла, часто, ожирения;
- Анамнеза: проявления синдромов гиперандрогении совпадает с периодом полового созревания и репродуктивного возраста;
- Данных осмотра: ожирение, гирсутизм, вышеописанные кожные проявления;
- Данных гормонального обследования: повышенный уровень свободного тестостерона, адренокортикотропного гормона, дегидроэпистендинона, пролактина;
- Данных УЗИ: склерокистозные яичники, увеличение объёма яичников или их опухоли, опухоли надпочечников;
- Снижения уровня глобулина, связывающего половые гормоны;
- Повышения уровня инсулина и нарушения толерантности глюкозы.
Лечение гиперандрогении у женщин
Можно ли вылечить гиперандрогению? Истинная функциональная гиперандрогения не вылечивается поскольку связана с врожденными дефектами ферментов. Лечения проводят для устранения тех или иных симптомов гиперандрогении у женщин. После прекращения лечения симптомы гиперандрогении могут возобновляться.
Лечение гиперандрогении у женщин яичникового генеза заключается в применении антиандрогенных препаратов стероидного (Диана 35, Ципротерон, Левоноргестрел) и нестероидного (Флутамин)типов.
При лечении гиперандрогении надпочечникового генеза используется Дексаметазон.

Лечение гиперандрогении, связанного с метаболическими нарушениями состоит в, повышенной физической нагрузки и снижающих средств, например, Метформина.
Синдром гиперандрогении у женщин, связанный с повышением уровня пролактина требует назначения пролактин снижающих препаратов (Алактин, Бромкриптин).
Лечение гиперандрогении опухолевого генеза заключается в оперативном удалении этих образований на яичниках, надпочечниках, гипофизе.
Гиперандрогения у девочек в раннем возрасте, как правило, связана с надпочечниковым верильным синдромом опухолевого генеза, требующего оперативного лечения. Функциональная гиперандрогения у детей появляется в периоде полового созревания.
Гиперандрогения при беременности
Бесплодие не всегда является следствием гиперандрогении. Однако она вызывает нарушение продукции гормонов эстрогенов и. При синдроме гиперандрогении этот гормон снижен. с данным синдромом показана назначение препаратов естественного прогестерона, особенно в первом триместре, когда идет «становление» плаценты. Гиперандрогения при беременности является фактором риска по невынашиванию и недонашиванию, развитию метаболического синдрома у детей.
Вы, наверное, обращали внимание на женщин, имеющих мужские черты в своем облике. Это может быть низкий голос, появление растительности на лице и теле, типичное для мужчин строение тела и тому подобное.
К такой ситуации чаще всего приводит избыточная секреция андрогенов или же их усиленное воздействие на организм женщины. В медицине подобная патология определяется как гиперандрогения.
Симптомы, причины возникновения и способы борьбы с ней мы и рассмотрим в этой статье.
Что провоцирует появление гиперандрогении?
Описываемое заболевание - наиболее часто встречающееся нарушение функций эндокринной системы у женщин. В результате исследований установлено, что у 20% представительниц слабого пола имеется диагноз гиперандрогения.
У женщин подобное состояние, как правило, обусловлено не только избыточным количеством мужских половых гормонов, вырабатывающихся яичниками или надпочечниками. Патологию провоцирует и усиление превращения андрогенов-предшественников в их еще более активную форму (например, тестостерон становится дигидротестостероном, активным в 2,5 раза больше). Усугубляет ситуацию и увеличение утилизации андрогенов, подталкиваемое повышенной чувствительностью органа (например, кожи) к этому гормону.
Некоторые особенности развития гиперандрогении
Так, гиперандрогения у женщин, симптомы которой проявляются, в частности, акне (угревой сыпью), развивается при увеличении чувствительности к андрогенам у сальных желез. Заметьте, что при этом уровень мужских половых гормонов в крови пациентки остается в норме!
Кроме того, на развитие гиперандрогении влияет и снижение количества глобулина, который связывает половые гормоны (в норме он не дает проникнуть свободному тестостерону в клетку крови и вступить во взаимодействие с андрогенными рецепторами).
Синтез глобулина происходит в печени, поэтому нарушения функции данного органа могут провоцировать начало гиперандрогении или же подстегивать ее развитие. Тот же эффект имеет и снижение уровня эстрогенов, вырабатывающихся щитовидной железой.

Признаки гиперандрогении у женщин
Гиперандрогения может проявляться вирилизацией, то есть возникновением у женщины мужских признаков. Как правило, это выражается в оволосении области груди, срединной линии живота, внутренней стороны бедер и усилении роста волос на лице. Зато в волосах на голове в это время могут появиться залысины (т. н. алопеция). Кроме этого, патологию часто сопровождают и косметические дефекты: акне (угревая сыпь), шелушение и воспаление кожи на лице (себорея), а также атрофия мышц живота и конечностей.
Для женщин с гиперандрогенией характерны нарушения менструального цикла или аменорея (отсутствие месячных), ожирение, гипертония, гипертрофия миокарда и бесплодие.
Кроме всего перечисленного, женщины, страдающие описываемой патологией, обычно обладают усиленной восприимчивостью к разным видам инфекций, склонностью к депрессиям, а также повышенной утомляемостью.
Кстати, помните, что данная патология не имеет возраста. Гиперандрогения у женщинможет проявиться в любой период жизни, начиная с рождения.
Как диагностируется гиперандрогения?
Описываемый диагноз не может быть поставлен только на основе внешних признаков, имеющихся у пациентки. Даже в случае, когда они кажутся весьма красноречивыми. Необходимо проведение ряда анализов и УЗИ внутренних органов. А ключевым методом диагностики данной патологии является исследование крови на количество стероидов.
Обратите внимание, что состояние больной может при этом проявляться и наличием сахарного диабета, синдрома Кушинга (который внешне выражается ожирением, лунообразным лицом и истончением конечностей), поликистозом яичников, опухолями надпочечников и т. п.
Как видите, все это предполагает самые разные методы, с помощью которых будет диагностироваться гиперандрогения у женщин.
Как различить гирсутизм и гипертрихоз?
Как выше было уже упомянуто, одним из самых ранних и постоянных симптомов появления описываемой патологии у женщин является избыточный рост волос на лице и теле (гирсутизм).

Но подобный признак не следует путать с гипертрихозом - состоянием, при котором оволосение проходит на любой части тела, в том числе и там, где рост волос не зависит от действия андрогенов.
А синдром гиперандрогении у женщин провоцирует появление волос именно в таких местах, то есть по мужскому типу: на лице (борода и усы), на груди, внутренней стороне бедер, на животе и нижней части спины, а также между ягодиц.
Пациентке с гирсутизмом, как правило, предлагается лечение, в которое включаются и косметические меры (эпиляция), и гормональная коррекция.
Влияние андрогенов на рост волос у женщины
Как же взаимосвязан рост волос с выработкой андрогенов в организме женщины? Дело в том, что именно количество данного гормона определяет, как и где будут расти волосы на теле женщины. Так, во время начала полового развития, у девушки именно под влиянием андрогенов под мышками и на лобке появляются в небольшом количестве волоски.
Зато если уровень гормонов начнет превышать норму, то оволосение появится и на лице, и на груди, и на животе. А очень высокий уровень андрогенов вызывает, кроме этого, еще и снижение роста волос на голове, отчего там возникают залысины надо лбом.
Причем, обратите внимание, что на рост пушковых волос, а также ресниц и бровей данный гормон влияния не оказывает.
Как развивается яичниковая гиперандрогения?
В медицине различаются три формы описываемого заболевания: яичниковая, надпочечниковая и смешанная.
К развитию первой формы патологии приводит дефицит ферментов, содержащихся в яичниках (речь идет, как правило, о наследственной патологии). Это мешает преобразованию андрогенов в женские половые гормоны - эстрогены и, соответственно, вызывает их накапливание. Как результат, у женщины развивается яичниковая гиперандрогения.
Кстати, то, какие именно андрогены (тестостерон, ДЭА-сульфат или андростендион) будут преобладать в крови пациентки, напрямую зависит от того, каких ферментов не хватает в ее организме.

Каким образом нарушается функционирование яичников?
Яичниковая форма заболевания чаще всего характеризуется поликистозом и гипертекозом (двусторонним увеличением) данного органа. Между прочим, у девочек, занимающихся силовыми видами спорта, высок риск приобретения данной патологии.
Это происходит из-за того, что избыточный уровень андрогенов приостанавливает рост фолликулов, из которых состоят яичники, в итоге приводя к их заращению (т. н. фолликулярной атрезии). Кроме того, он стимулирует развитие патологического образования волокнистой соединительной ткани (фиброза) и вызывает поликистоз.
По принципу обратной связи данный синдром гиперандрогении у женщин приводит к сбою в центральной регуляции уровня андрогенов (на уровне гипофиза и гипоталамуса), что, в свою очередь, сильно изменяет гормональный фон.
Надпочечниковая гиперандрогения
Теперь поговорим о надпочечниковой гиперандрогении. Вы наверняка знаете, что надпочечники - это пара небольших эндокринных желез, которые располагаются над почками. Они, между прочим, вырабатывают 95% андрогена под названием ДЭА-сульфат.
Особенностью патологии этого органа является то, что надпочечниковая гиперандрогения у женщин чаще всего носит врожденный характер. Она возникает в результате андрогенитального синдрома.
Подобный синдром вызывает отсутствие ферментов, способствующих выработке гормонов глюкокортикоидов, которые в норме производятся корой надпочечников. Это и приводит к тому, что в крови накапливаются их предшественники (прогестерон, прегненолон и т. п.), вынуждая организм использовать их для избыточного производства андрогенов.
Реже встречается гиперандрогения, вызванная опухолями надпочечников, выделяющими андрогены (такая патология носит название болезни Иценко-Кушинга).

Смешанная гиперандрогения
Периодически встречается и смешанная гиперандрогения у женщин. Причины возникновения ее кроются в одновременном нарушении функций яичников и надпочечников.
Из-за повышения уровня надпочечниковых андрогенов усиливается их образование и в яичниках, а повышенное содержание в крови последних стимулирует гипофиз, вынуждая его к усиленному продуцированию лютеинизирующего гормона, провоцирующего формирование гиперандрогенного синдрома.
Смешанная форма возникает также в результате перенесенных травм, опухолей гипофиза или интоксикации мозга у женщины.
Чем опасна гиперандрогения во время беременности?
Кроме проблем, перечисленных выше, описываемая патология опасна для женщин, желающих зачать и выносить ребенка. Так, например, гиперандрогения при беременности является причиной от 20 до 40% выкидышей или замираний плода, которые происходят на ранних сроках.
И заметьте, что такое положение вещей печально уже потому, что и сами по себе прерывания беременности усугубляют гормональные нарушения. А в данном случае, на фоне имеющихся гормональных изменений, это и вовсе приводит в итоге к тому, что беременность в дальнейшем становится невозможной.

Прогноз вынашивания беременности при гиперандрогении
Если женщина обращается к специалисту со специфическими жалобами, которые были перечислены выше, то ей обязательно будет назначено обследование на исключение описываемой патологии.
При правильной диагностике и адекватном лечении гиперандрогения при беременностине мешает пациентке успешно выносить и родить ребенка. Этому помогают препараты, снижающие в крови уровень андрогенов. Их больной необходимо принимать регулярно на протяжении всего срока беременности.
Как лечат гиперандрогению?
Прежде чем начать лечение гиперандрогении у женщин, требуется пройти детальное обследование для выявления типа заболевания и причин, спровоцировавших его развитие.
Если женщина не планирует рождение ребенка, то врач подбирает пациентке оральные контрацептивы, которые имеют антиандрогенный эффект. В противоположном случае назначаются препараты, стимулирующие выход яйцеклетки, а иногда применяется и клиновидное иссечение яичника, чтобы помочь яйцеклетке выйти из него.
В случае выявления высокого уровня андрогенов, которые организм не может утилизировать, больным, как правило, назначаются препараты «Дексаметазон» и «Метипрет», которые повышают в организме количество женских гормонов.
Если заболевание спровоцировано наличием опухоли, то пациентке показано оперативное вмешательство. К этому же вынуждает специалистов и поликистоз яичника. Как правило, удаляется его большая часть.
При надпочечниковой форме заболевания применяется гормональная терапия, включающая глюкокортикоидные гормоны (например, средство «Дексаметазон»). Кстати, его назначают в поддерживающей дозе и во время беременности.

Лекарственные средства, применяемые для лечения гиперандрогении
Для улучшения состояния кожи при описываемом заболевании применяют препарат «Диане-35», который подавляет выработку андрогенов надпочечниками и яичниками, а также выброс гипофизом в кровь женщины лютеинизирующего гормона. При этом ципротеронацетат, входящий в состав препарата, блокирует чувствительные к андрогенам кожные рецепторы, не давая связываться с ними.
Как правило, для повышения эффективности названный препарат назначают в сочетании со средством «Андрокур». Эти препараты помогают женщинам, имеющим выраженную угревую болезнь. Но действие их можно будет оценить лишь спустя 3 месяца после начала лечения.
Весьма эффективна и терапия антиандрогенными препаратами «Янина» и «Жанин». Лечение гиперандрогении у женщин с помощью названных средств длится не менее полугода. Оно не вызывает увеличение массы тела и способствует нормализации менструального цикла.
Есть ли народные средства, помогающие при гиперандрогении?
Известен довольно широкий круг лекарственных трав, которые включаются в обменные процессы женского организма и позитивно влияют на процессы регулирования равновесия гормонов.
Конечно, при таком заболевании, как гиперандрогения, лечение народными средствами - совсем не панацея, но, например, такое средство, как цимифуга (или, по-иному, клопогон) может помочь в случаях нарушения гормонального баланса. Не менее эффективен и прутняк священный, на основе которого производится препарат «Циклодинон».
Впрочем, можно перечислить целый список представителей флоры, которые наряду с назначенными специалистом лекарственными препаратами помогут отрегулировать гормональное равновесие: корень солодки, мята, дягиль, пион уклоняющийся и т. д. Готовые сборы таких растений продаются в аптечной сети и всегда готовы облегчить состояние женщины.
Несколько слов напоследок
Не пытайтесь лечить патологию самостоятельно! Если вам поставлен диагноз «гиперандрогения», отзывы знакомых или родственников о каких-либо «волшебных» средствах не помогут решить проблему.
Неверно проведенное лечение может иметь для женщины весьма серьезные последствия. Поэтому при подозрении на болезнь в первую очередь необходимо обратиться к гинекологу и эндокринологу. Их совместные усилия и ваши терпение и настойчивость помогут остановить развитие патологии и не допустить необратимых последствий.
Синдром гиперандрогении у женщин – это эндокринная патология, которая развивается вследствие чрезмерной активности в организме андрогенов (мужских половых гормонов). Это отклонение встречается так же часто, как и патология щитовидной железы. Существует много факторов, которые могут спровоцировать это заболевание:
- Синдром Кушинга (повышение уровня гормонов в коре надпочечников);
- Болезни щитовидной железы;
- Гормонопродуцирующие опухоли яичников;
- Болезнь Френкеля (разросшаяся строма яичников);
- Действие гормональных препаратов;
- Болезни печени, которые перешли в хроническую форму;
- Наличие синдрома гиперандрогении у ближайших родственников;
- Поликистоз яичников;
- Доброкачественная опухоль гипофиза (пролактинома), которая производит гормон (пролактин), отвечающий за развитие груди и выработку молока;
- Избыточная выработка андрогенов надпочечниками.
Различают 3 вида гиперандрогении: смешанную, надпочечниковую и яичниковую. Также гиперандрогению делят на первичную (нарушение функционирования коры надпочечников или яичников) и вторичную (сбои в работе гипоталамуса и гипофиза), врождённую и приобретённую.
Клиническая картина недуга может быть ярко и слабовыраженной. Основные симптомы:
- Акне – заболевание кожи, вызванное воспалением сальных желёз. Оно является одним из факторов зарождения и развития синдрома гиперандрогении. Эта болезнь характерна для пубертатного этапа развития, потому признаки акне (красные болезненные угри, чёрные точки, комедоны) наблюдаются у большинства подростков. Если такие воспаления на коже не проходят даже во взрослом возрасте, следует пройти обследование на гиперандрогению, которая, в свою очередь, может быть следствием поликистоза яичников. В некоторых случаях акне сопутствует себорея (чрезмерная активность сальных желез на определённых участках кожи), которую могут вызвать андрогены.
- Алопецией называют стремительное облысение. При андрогенной алопеции происходит изменение волосяной структуры. Сначала волосы становятся очень тонкими и бесцветными, а затем начинается выпадение. Этот признак говорит о том, что гиперандрогения прогрессирует уже долгое время.
- Гирсутизм – появление избыточного количества жёстких и тёмных волос на лице, руках, груди. Это заболевание почти всегда сопровождается бесплодием и скудными менструациями.
Вирильный синдром. Вирилизация – это редкая патология, при которой у женщины проявляются исключительно мужские черты. Причинами вирильного синдрома могут быть новообразование на надпочечниках, адренобластома и гиперплазия яичников. При вирилизации наблюдаются следующие симптомы:
- Нерегулярные менструации, аменорея;
- Повышенное либидо;
- Акне;
- Изменение тембра голоса;
- Увеличение мышечной массы;
- Увеличение и набухание клитора;
- Лишний вес в верхней части тела;
- Алопеция (облысение в области пробора);
- Рост волос вокруг сосков, на животе, щеках.
Есть также симптомы, которые встречаются гораздо реже:
- Артериальная гипертония;
- Ожирение;
- Сахарный диабет 2-го типа;
- Чувствительность рецепторов клеток к мужским гормонам.
Синдром гиперандрогении может возникнуть в любом возрасте. Девушки, страдающие этой болезнью, предрасположены к депрессиям, переутомлению и простудам. Признаки патологии могут быть вызваны также недостатком эстрогенов (женских половых гормонов) и нехваткой белка, который регулирует активность андрогенов.
Диагностика

Многие неопытные врачи диагностируют гиперандрогению только при условии большого количества андрогенов в организме. По этой причине женщины с гиперандрогенией, у которых уровень андрогенов в норме, не получают своевременного лечения. Вследствие этого признаки болезни становятся более ярко выраженными, у пациентки ухудшается самочувствие. В большинстве случаев синдром гиперандрогении возникает при умеренном количестве андрогенов.
При диагностике используют: лабораторные исследование генов, анализ на концентрацию дегидроэпиандростерон сульфата и инструментальные методы обследования (УЗИ, сцинтиграфия, КТ, МРТ), составляют анамнез (когда впервые появились симптомы, какие лекарства принимала женщина в последнее время). Проводят клинический осмотр пациентки: высыпания на коже, чрезмерный рост волос, огрубение голосового тембра, структура волос на теле и гинекологический осмотр (размер клитора и половых губ). Вместе с тем специалисты определяют уровень тестостерона, фолликулостимулирующего и лютеинизирующего гормонов. Но далеко не всем женщинам необходимо исследование гормонального фона. При таких симптомах, как акне и себорея, уровень мужских половых гормонов обычно не превышает норму, потому стандартных процедур будет вполне достаточно.
Гирсутизм является более точным диагностическим показателем повышенной активности мужских гормонов, чем высокий уровень тестостерона в крови. Второй показатель может быть в норме при том, что признаки заболевания давно проявились.
Одним из важнейших диагностических критериев считается андрогенная алопеция. Важен тот факт, что сначала волосы выпадают на висках, а затем на теменной области.
Лечение и профилактика

Лечение женщине назначается с учётом формы гиперандрогении и причин, которые её вызвали. Если заболевание спровоцировали опухоли надпочечников и яичников, необходимо удалить их хирургическим путём. Если же причиной послужили не опухоли, а сбои в функционировании гипофиза и гипоталамуса, то терапия будет зависеть от цели, которой хочет достигнуть женщина при лечении. Такими целями могут быть устранение симптомов и признаков болезни и восстановление фертильности. В случае неправильной работы названных участков мозга у женщины появляется лишний вес, потому его нормализация – это главный этап лечения. Для этого нужно отрегулировать рацион, заняться спортом.
Если женщина не планирует ребёнка, но хочет избавиться от неэстетичных проявлений гиперандрогении, ей назначаются антиандрогенные оральные контрацептивы (Диане – 35).
В случае, если заболевание возникло вследствие отсутствия фермента, который трансформирует мужские половые гормоны в глюкокортикоиды, назначают такие препараты, как Метипред и Дексаметазон.
При нарушении репродуктивной функции, которое связано с яичниковой или надпочечниковой гиперандрогенией, женщине назначаются препараты, которые заставляют яйцеклетку выйти из яичника (Кломифен).
Если препараты не помогли полностью избавиться от недуга, применяются хирургические способы. Самый популярный из них – лапароскопия. Она осуществляется путём введения в брюшную полость специального приспособления, которое выводит изображение на экран. После этого делается второй разрез, через который с помощью хирургических инструментов на яичники наносят своеобразные «зарубки», чтобы яйцеклетка смогла свободно выйти.
Чтобы предотвратить болезнь, следует несколько раз в год посещать гинеколога, следить за колебаниями веса, придерживаться правильного питания, отказаться от вредных привычек, вовремя лечить болезни печени и щитовидной железы, избегать стрессовых ситуаций.
Народные методы лечения

Народные способы не помогут полностью вылечить синдром гиперандрогении у женщин, но они очень хороши как вспомогательное средство. Вот несколько самых действенных рецептов:
- Настойка из базилика. Добавьте 2 столовые ложки в стакан кипятка, потом снова прокипятите смесь, ещё 10 минут продержите её на медленном огне. После этого остудите отвар, процедите. Принимать нужно 2–3 раза в день по 100 мл.
- Настой боровой матки. Сперва нужно просушить примерно 50 г листьев растения. После этого раскрошите их, смешайте с 500 мл водки. Залейте смесь в ёмкость, оставьте на месяц. На настойку не должен попадать свет. Принимать нужно не меньше 4-х раз в день по 35 капель.
- Настойка из солодки. Одну столовую ложку солодки добавьте ёмкость с кипятком (200 мл). Оставьте настой на час, а затем процедите. Весь настой нужно выпивать натощак с утра.
- Травяной сбор из красной щетки, пустырника, рябины, крапивы, коры калины, ромашки, пастушьей сумки. Все эти травы измельчите с помощью блендера, перемешайте. 2 столовые ложки смеси добавьте в 500 мл кипятка, оставьте настаиваться на 7–8 часов. Выпить настойку нужно за один день. Употреблять сбор необходимо 2–3 месяца.
- Настойка из красной щетки. Одну столовую ложку очищенного растения добавьте в ёмкость с кипятком (200 мл). Оставьте отвар настаиваться (на один час), потом процедите, остудите. Принимать настой нужно не менее трёх раз в день за полчаса до еды.
- Сбор из красной щетки и левзеи. Измельчите травы, смешайте их. Затем одну чайную ложку смеси высыпьте в воду (один стакан). Принимайте настой 3–4 раза в день за полчаса до еды.
Обратите внимание, что употребление красной щетки при гипертонии категорически противопоказано. Кроме этого любое самостоятельное лечение, в том числе и народными методами без консультации с врачом может нанести серьезный вред здоровью.
Гиперандрогения (или гиперандрогенемия)- это повышенный уровень мужских половых гормонов андрогенов. Андрогены в разных концентрациях присутствуют и у мужчин и у женщин. Гиперандрогения у женщины приносит много проблем. Эта патология является наиболее частой причиной аменореи (отсутствия менструаций) и женского бесплодия.
Яичники у женщин состоят из фолликулов - яйцеклеток, окружённых слоями клеток. Избыточный уровень мужских половых гормонов андрогенов тормозит рост фолликулов и в итоге способствует их заращению (фолликулярной атрезии). Кроме того он провоцирует развитие фиброза капсулы яичников (фиброз - патологическое образование волокнистой соединительной ткани) и приводит их к состоянию поликистоза - образованию множественных кист (синдром поликистозных яичников).
Для того, чтобы понять эту сложную тему, необходимо запомнить следующие термины:
Гипоталамус - отдел головного мозга, высший центр регуляции, контролирующий обмен веществ, работу эндокринных и половых желез, место взаимодействия нервной и гормональной систем
Гипофиз - основная эндокринная железа, расположена в основании головного мозга; под руководством гипоталамуса регулирует действие гормональной системы.
Нарушения центрального происхождения - значит нарушения регуляции со стороны головного мозга, то есть со стороны гипоталамуса и гипофиза. Проявляется это нарушением выделения гормонов гипоталамуса и гипофиза, которые действуют на гормональные железы, нарушая выделение в кровь их гормонов.
Надпочечники - пара маленьких эндокринных желез, расположенных над почками и состоящих из двух слоёв - внешнего- коркового и внутреннего- мозгового
Проба с дексаметазоном - введение препарата с последующим лабораторным определением уровня анлрогенов с целью определения источника гиперандрогении
А также гормоны, которые задействованы в формировании гиперандрогенного синдрома:
Тестостерон, андростерон, андростендион - мужские половые гормоны, андрогены
ДЭА-сульфат (ДЭА-С, ДЭА-S ) - андроген, гормон, который на 95% вырабатывается в надпочечниках и на 5% в яичниках
Эстрадиол - женский половой гормон
Пролактин - гормон гипофиза
Фолликулостимулирующий гормон (ФСГ) - гормон гипофиза
Лютеинизирующий гормон (ЛГ) - гормон гипофиза
Адренокортикотропный гормон (АКТГ) - гормон гипофиза
Кортизол - гормон коры надпочечников
17-гидроксипрогестерон - гормон надпочечников
17-кетостероиды - продукт обмена андрогенов, выделяется с мочой, по их концентрации составляют представление о концентрации андрогенов
ССГ (секссвязывающий или стероидсвязывающий глобулин) - его функция транспортировать половые гормоны к органам
Каковы же причины развития гиперандрогенного синдрома? Источником повышенной продукции андрогенов могут быть
яичники
кора надпочечников
Поэтому так и принято различать - яичниковую гиперандрогению и надпочечниковую гиперандрогению
I. Гиперандрогения яичниковая
Самая распространённая причина яичниковой гиперандрогении - синдром поликистозных яичников. Гораздо реже её может вызвать опухоль яичников, выделяющая андрогены.
Но какого бы происхождения не был повышенный уровень андрогенов, он всё равно ведёт к развитию синдрома поликистозных яичников.
А. Синдром поликистозных яичников
Его ещё называют синдром Штейна-Левенталя. В его основе лежит наследственный дефицит ферментов яичников. Андрогены, претерпевая ряд изменений, должны в организме женщины превратиться в женские половые гормоны эстрогены. Недостаток фермента блокирует это превращение и в результате в организме женщины накапливаются мужские половые гормоны андрогены. Продукция эстрогенов снижается и это снижение впрямую зависит от степени недостатка ферментов. Причём от того, какого именно фермента не хватает зависит, какие именно андрогены будут преобладать (тестостерон, ДЭА- сульфат, андростендион)
Ферменты, недостаток которых приводит к синдрому поликистозных яичников:
19 - гидроксилаза (накапливается тестостерон)
бетаол-дегидрогеназа (очень высокий уровень ДЭА-сульфата, андростендиона и менее высокий тестостерона)
3-бетаол-дегидрогеназа (менее серьёзные изменения, уровень женских половых гормонов эстрогенов почти в норме)
Нарушение выработки женских половых гормонов в яичниках по принципу обратной связи ведёт к сбою цетральной регуляции (на уровне гипоталамуса и гипофиза).
В результате у больных синдромом Штейна-Левенталя выявляется следующий гормональный фон:
высокий уровень андрогенов (тестостерон, андростендион с преобладанием андростендиона)
увеличение уровня ЛГ при нормальном уровне ФСГ и пролактина.
соотношение ЛГ/ФСГ значительно увеличено (до 5 при норме менее 1,5)
уровень эстрадиола такой же как у здоровых женщин или снижен
при пробе с дексаметазоном уровень 17-кетостероидов в моче снижается менее, чем на 50%, что подтверждает яичниковое происхождение гиперандрогении.
Б. Яичниковая гиперандрогенемия опухолевого происхождения.
Гормонально-активные опухоли яичников выделяют мужские половые гормоны - тестостерон, андростендион, ДЭА-сульфат. Основным проявлением опухолей яичников, выделяющих гормоны, является высокий уровень тестостерона в крови (в 10-12 раз выше нормы). Корелляции между содержанием тестостерона в крови и размерами опухоли обычно нет. При пробе с дексаметазоном содержание тестостерона в крови достоверно не изменяется.
Уровень женского полового гормона эстрадиола в крови обычно в норме или снижен. Но если опухоль одновременно выделяет и мужские и женские половые гормоны, то содержание эстрадиола повышено. Уровень гормонов гипофиза ЛГ и ФСГ у таких пациенток находится в пределах нормы. Редко выявляют снижение ФСГ. В единичных случаях содержание ФСГ превышает норму. Уровень пролактина в крови часто повышен.
II Гиперандрогения и синдром поликистозных яичников центрального происхождения.
Синдром поликистозных яичников центрального происхождения обусловлен повышенным выделением в кровь гормонов гипофиза ЛГ и ФСГ. Нередко такие нарушения регуляции со стороны головного мозга возникают как результат острой или хронической инфекции или интоксикации (частые ангины, ревматизм, туберкулёз), а также психической травмы. В крови увеличивается уровень ЛГ, может снижаться содержание ФСГ и как результат соотношение ЛГ/ФСГ достигает 3 и более. Для роста и развития фолликулов и наступления овуляции (выход яйцеклетки из яичника) этот показатель не должен превышать 1,5.
Значительную роль в развитии синдрома поликистозных яичников центрального происхождения имеет высокий уровень пролактина, которую обнаруживают у 30% пациенток с данным синдромом.
Изменение содержания ФСГ, ЛГ и пролактина ведёт к нарушеню стимуляции яичников, в результате уменьшается число созревающих фолликулов, нарушается выработка половых гормонов - увеличивается продукция основного мужского полового гормона тестостерона и снижается выработка основного женского гормона эстрадиола. У большей части пациенток наблюдается такой гормональный фон:
незначительное повышение уровня ЛГ
снижение уровня ФСГ
соотношение ЛГ/ФСГ в 4-5 раз выше нормы
уровень пролактина в норме
уровень тестостерона повышен
уровень эстрадиола снижен или на нижней границе нормы
уровень ДЭА-сульфата в крови в пределах нормы
III Надпочечниковая гиперандрогения
Причины гиперандрогении надпочечникового происхождения:
адреногенитальный синдром (АГС) - наиболее частая причина
опухоли надпочечников, выделяющие андрогены (встречаются редко)
Причина адреногенитального синдрома - отсутствие ферментов, которые в норме способствуют выработке гормонов коры надпочечников (глюкокортикоидов). Блокада выработки глюкокортикоидов ведёт к тому, что в крови накапливаются предшественники, из которых вырабатываются эти гормоны надпочечников (прегненолон, прогестерон, 17-гидроксипрогестерон). Организм использует их для избыточной продукции андрогенов.
Ферменты, дефицит которых приводит к развитию адреногенитального синдрома (АГС):
21-гидроксилаза
11-бета-гидроксилаза
3-бета-гидроксистероиддегидрогеназа
Блок этих ферментов приводит к развитию АГС уже в детском возрасте. У взрослых пациенток как правило наблюдается неполный, лёгкий дефицит ферментов, что не влечёт за собой ярких проявлений повышенной функции коры надпочечников.
Часто наблюдается комбинация надпочечниковых и яичниковых причин гиперандрогении, потому что сама по себе гиперандрогения способствует повышенному образованию андрогенов в яичниках вследствие стимуляции яичников гормоном гипофиза ЛГ. Об этом писалось выше.
Реже встречаются случаи надпочечниковой гиперандрогении, вызванной опухолями, выделяющими адренокортикотропный гормон (АКТГ). Такая патология называется болезнью Иценко-Кушинга.
Для лабораторной диагностики надпочечниковой гиперандрогении назначают следующие гормоны:
Тестостерон
Андростерон
ДЭА-сульфат (ДЭА-С, ДЭА-S
ФСГ
ЛГ
АКТГ
Кортизол
17-гидроксипрогестерон
ССГ
ДЭА-сульфат на 95% синтезируется в надпочечниках и только на 5% в яичниках. Поэтому определение его в крови позволит выявить происхождение андрогенов. Аналогичную диагностическую функцию выполняет определение 17-гидроксипрогестерона. Кроме того назначают пробу с дексаметазоном. Дексаметазон подавляет высвобождение АКТГ из гипофиза, а значит выключает стимулирующее действие АКТГ на выработку гормонов в коре надпочечников. Поэтому, если андрогены имеют надпочечниковое происхождение, лабораторная диагностика выявит падение уровня андрогенов в крови.
IV Смешанная форма гиперандрогении и синдрома поликистозных яичников.
Часто встречается сочетание яичниковых и надпочечниковых причин гиперандрогении. Повышенный уровень надпочечниковых андрогенов влечёт за собой усиленное образование андрогенов в яичниках. А высокое содержание в крови яичниковых андрогенов стимулирует гипофиз к усиленной продукции лютеинизирующего гормона (ЛГ). Для тех, кто глубже хочет разобраться в процессе поясню, что не сам высокий уровень андрогенов ведёт к повышению ЛГ. Из андрогенов в процессе обмена веществ (особенно в жировой ткани) образуются женские половые гормоны эстрогены и именно их избыток (особенно одного из них - гормона эстрона) приводит к стимуляции гипофиза и выбросу ЛГ.
Лабораторная диагностика сочетанной формы синдрома поликистозных яичников предусматривает исследование широкого спектра гормонов:
тестостерон
андростерон
ДЭА-сульфат
пролактин
ФСГ
ЛГ
АКТГ
кортизол
17-гидроксипрогестерон
17-кетостероиды
ССГ
Уровень ЛГ в крови повышен, но его повышение менее выражено, чем у больных с синдромом Штейна-Левенталя (синдром поликистозных яичников). Содержание ФСГ снижено. Отношение ЛГ/ФСГ составляет в среднем 3,2 при норме менее 1,5. Уровень пролактина в норме. Уровень тестостерона умеренно повышен, а эстрадиола снижен. Содержание 17-КС в моче и уровень ДЭА-сульфата в крови повышены. Определение ДЭА-сульфата позволяет отдифференцинровать происхождение андрогенов (надпочечники или яичники).
Гиперандрогенный синдром у женщин является основной причиной выпадения волос и угревой болезни (розацеа).
http://gormonyplus.ru/giperandrogennyj-sindrom